Карбонаты и оксиды кремния в природе. Химические и физические свойства диоксида кремния - формула, описание вещества и воздействие на человека
Химическое соединение диоксид кремния обладает структурой с повышенной твердостью, является составным элементом пищевых продуктов, его можно обнаружить в керамике, бетоне, медицинских препаратах, косметических средствах. Ознакомьтесь с химическими свойствами, способами применения, влиянием на организм человека, возможной пользой и вредом диоксида.
Диоксид кремния – что это такое
Silica, Silicon dioxide, кремнезем – все эти определения равны термину двуокись кремния. Это соединение состоит из бесцветных кристаллов, обладающих повышенной прочностью, твердостью и пластичностью. В природе оно встречается широко: кристаллические модификации представлены минералами яшмой, агатом, горным хрусталем, чистым кварцем, халцедоном, аметистом, морионом, топазом.
При естественной температуре окружающей среды и нормальном атмосферном давлении выделяют три модификации моноксида кремния: тридимит (песок), кристаллы кварца и кристобалит. Если повысить температуру, кристаллическое вещество станет коэситом, а затем стишовитом. Последнее является производным веществом, составляющим мантии Земли и ее коры. На нашей планете высший оксид занимает 87% всей литосферы, в плазме крови человека его концентрация составляет 0,001%.
Химические свойства
Высший оксид кремния устойчив к воздействию кислот, атомов кислорода, не растворяется водой. При повышенной температуре растворяется щелочами, плавиковой кислотой, обладает диэлектрическими свойствами. Бесцветные кристаллы характеризуются высокой прочностью, тугоплавкостью, твердостью. Атомы кремния не проводят ток. Вещество относится к группе стеклообразующих оксидов кремния.
Диоксид кремния – влияние на организм человека
По данным исследований, вещество проходит через желудочно-кишечный тракт человека в неизмененном состоянии, полностью выводится из организма. Ученые обнаружили пользу соединения – вода с повышенным содержанием пищевого натурального диоксида снижает риск развития болезни Альцгеймера. При производстве пищевых продуктов вещество обозначается, как эмульгатор Е551.
Он не изменяет вкусовых качеств продуктов, не влияет на цвет, но придает сыпучесть и текучесть порошкам, предупреждает появление комков, гасит пену, играет роль загустителя. Для медицинских целей применяется для погашения газообразования. Ученые говорят, что двуокись кремния не наносит вреда организму, не всасывается кишечником. Возможным отрицательным эффектом обладают соединения кремния с прочими химическими веществами: приводят к раздражению дыхательных путей.
Применение оксида
Кремний окисляется, приобретает новые свойства, поэтому используется в качестве эмульгатора и вещества, препятствующего слеживанию и комкованию. Природный диоксид находит применение в следующих отраслях:
- пищевая промышленность;
- производство бытовой химии, лекарственных средств;
- выпуск керамики, стекла, абразивов, бетонных изделий;
- наполнитель при производстве резины, кремнеземистых огнеупоров;
- в микроэлектронике диоксид (продукт окисления кремния) находит применение в сфере хроматографии;
- использование в ультразвуковых установках, радиотехнике за счет пьезоэлектрических свойств;
- плавленый диоксид применяется в производстве волоконно-оптических кабелей, изоляторов.
Диоксид кремния в косметике
Элемент часто применяют при производстве зубных паст. Им заменяют некоторые опасные ингредиенты, служащие для отбеливания эмали. Двуокись не наносит вреда зубам, но эффективно отбеливает их поверхность, выступая абразивом. За счет матирующего действия соединение используется в производстве лосьонов, кремов, пудры для жирной кожи. Добавка сглаживает неровный рельеф, устраняет морщины. Другим полезным свойством пленки диоксида является ее пилингующий эффект – она убирает отмершие клетки эпидермиса.
Пищевая промышленность
Пищевую добавку Е551 используют в производстве чипсов, сухариков, кукурузных палочек, растворимого кофе. За счет нее улучшается сыпучесть продуктов, предотвращается появление комочков. Также двуокись кремния добавляют в сахар, сухие сливки и молоко, соль, пшеничную муку, специи, яичный порошок. Добавкой обогащают снеки, алкогольные напитки, кондитерские изделия для предотвращения образования избыточного количества пены.

Строительство
Материалы, содержащие кремний диоксид, нашли широкое применение в области высоких технологий и строительных материалов. Вещество применяется в производстве стекла, керамики, бетонных изделий, абразивов. Его используют в радиотехнике, установках для производства ультразвука, зажигалках. Аморфный непористый элемент в сочетании с другими компонентами применяется в изготовлении кабеля.
В медицине
Для медицинских целей применяется коллоидный непористый диоксид, представляющий собой рыхлый бело-голубой порошок без запаха. В сочетании с водой он формирует взвесь, используется в качестве энтеросорбента. Вторым направлением использования становится терапия порошком гнойно-воспалительных поражений мягких тканей: гнойных ран, флегмон, абсцесса, мастита.
Лекарственными свойствами аморфного кремнезема считаются абсорбция токсинов, аллергенов, микроорганизмов и прочих агрессивных продуктов обмена веществ. Коллоидное вещество способно связывать и устранять из тела эндо- и экзогенные вещества, патогенные бактерии. Аморфный кремнезем проявляет активность в отношении к солям тяжелых металлов, радионуклидам, избытку холестерина, продуктам распада алкоголя. Двуокись кремния сохраняет нормальные компоненты флоры ЖКТ, не нарушает пищеварение.
Препараты, в которых содержится диоксид кремния
В медицине и фармакологии выделяют следующие препараты, содержащие синтетический диоксид:
- Полисорб – удаляет из организма накопившиеся токсины и шлаки, болезнетворные вирусы и бактерии;
- Силицея – реагирует на недостаток кремния в организме, содержит легкоусвояемую форму элемента;
- Флорасил – суточная дозировка укрепляет иммунитет, нормализует обменные процессы, укрепляет кости, волосы, ногти, нормализует обменные процессы кожи.
Показания к применению
Коллоидный кремнезем продается под аналогичным названием через аптеки, применяется для следующих случаев:
- гнойно-воспалительные патологии мягких тканей;
- пищевые токсикоинфекции;
- острые кишечные инфекции;
- аллергические реакции;
- острые отравления ядовитыми средствами;
- экзо- и эндогенные интоксикации;
- абстинентный алкогольный синдром.
Дозировка и способ применения аморфного диоксида зависят от типа и тяжести течения болезни, назначаются врачом:
- Местно препарат применяется на ранах – накладывается слоем 4-6 мм на предварительно обработанную поверхность, закрывается сухой асептической повязкой. Перевязки обновляют каждые сутки.
- Фракционные проточные промывания – до шести раз за день. Используется 1-3%-ная водная взвесь.
- Внутрь – аэросил применяется за час до приема пищи. При тяжелой диарее разовая доза составляет 4-6 г, суточная – 12 г, курс длится 3-5 дней. Токсико- и кишечные инфекции: трижды за сутки по 2-3 г. Алкогольный синдром: 3-4 раза за день по 2-4 г, курсом 3-4 дня. Острые пероральные отравления: разовая доза 0,1-0,15 мг/кг веса человека, разделенные на 2-3 приема. Тяжелые отравления: после промывания желудка через зонд кремний вводят каждые 4-6 часов максимальной суточной дозой 24 г. Аллергия: 2-3 раза за сутки по 2-3 г курсом 10-15 дней.

Человечество познакомилось с кремнием еще в древности. Именно из этого вещества первобытные люди делали свои орудия труда. А гораздо позже именно на основе кремния люди сделали стекло. Несмотря на то, что соединения кремния известны очень давно, чистый кремний был получен сравнительно недавно. Великий ученый Берцелиус в 1823 году смог получить чистый аморфный кремний, а в 1854 году А. Сент Клер Девил получил кристаллический кремний. Название элемента в переводе означает “твердый камень”, что вполне правильно характеризует его физические свойства.
В природе кремний не встречается в чистом виде, чаще всего он представлен оксидом SiO 2 , минералами или солями кремниевой кислоты.
Особое значение имеет минералы на основе кремния. Силициум — основа таких минералов как кремень, асбест, отоклаз, полевой шпат, кварц и хрусталь. Данные минералы образуют целые горы, а многочисленный песок не что иное, как измельченный кварц с многочисленными примесями. В животных и растениях кремний не распространен. Его количество в тканях живых существ невелико, а с возрастом его количество уменьшается.
Кремний получают восстановлением его оксида при высоких температурах:
SiO 2 +С = Si+2CO
3SiO 2 +4Al = 3Si+2Al 2 O 3
Также кремний можно получить при термическом разложении силана (водородное соединение кремния)
Кремний – типичный неметалл, ему присущи все типичные свойства его группы.
1) Взаимодействие с кислородом
Полученный оксид кремния 4 инертен по своим свойствам, трудно вступает в реакции, но активно реагирует с плавиковой кислотой:
4HF+SiO 2 = SiF 4 +2H 2 O
2) Взаимодействие с галогенами
При комнатной температуре кремний реагирует только со фтором, при нагревании – с хлором.
Si+2Cl 2 = SiCl 4
3) Взаимодействие с углеродом
Si+C = Si +4 C -4
В результате данной реакции получается вещество карборунд. Оно обладает уникальными физическими свойствами: его прочность подобна прочности алмаза.
В карборунде углерод проявляет отрицательную степень окисления, а кремний – положительную, что обусловлено положением этих элементов в периодической таблице.

4) Взаимодействие с металлами
Si+2Mg = Mg 2 Si
Si+4Na = Na 4 Si
Полученные вещества называют силицидами. При действии на них сильных кислот выделяется газ силан, который по своим химическим свойствам сильно напоминает алканы, но гораздо менее устойчив из-за большой длины связи.
5) Восстановление оксидов
При повышенной температуре кремний способен восстановить многие металлы из их оксидов.
2CuO+Si = SiO 2 +2Cu
6) Взаимодействие со щелочами
При повышенной температуре кремний вступает в реакцию с растворами щелочей
Si+2NaOH+H 2 O = Na 2 SiO 3 +2H 2 (метаксилат натрия)
Si+4NaOH = Na 4 SiO 3 +2H 2 (ортоксилат натрия)
8. Кремний
Свойства
14 Si.|
Атомная масса |
кларк, ат.% (распространненость в природе) |
||
|
Электронная конфигурация* |
Агрегатное состояние |
твердое вещество |
|
|
темно-серый блестящий |
|||
|
Энергия ионизации
|
|||
|
Относительная электро- отрицательность |
Плотность |
||
|
Возможные степени окисления |
Стандартный электродный потенциал |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе.
Кремний после кислорода - самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO 2 и соли кремниевых кислот - силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных.Природные силикаты имеют сложный состав и строение. Вот состав некоторых природных силикатов: полевой шпат К
2 О× А l 2 O 3 × 6SiO 2 , асбест 3 Mg О× 2SiO 2 × 2H 2 O, c люда К 2 О× 3 А l 2 O 3× 6SiO 2 × 2H 2 O, каолинит 3 А l 2 O 3 × 2SiO 2 × 2H 2 O.Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами. Из названных выше силикатов алюмосиликатами являются полевой шпат, каолинит и слюда. В природе наиболее распространены именно алюмосиликаты, например полевые шпаты. Распространены также смеси различных силикатов. Так, горные породы - граниты и гнейсы - состоят из кристалликов кварца, полевого шпата и слюды
.Основным продуктом разрушения является минерал каолинит - главная составная часть белой глины. В результате выветривания горных пород образовались залежи глины, песка и солей.
Получение. В промышленности кремний получают восстановлением
SiO 2 коксом в электрических печах:В лаборатории в качестве восстановителей используют магний или алюминий:
Наиболее чистый кремний получают восстановлением тетрахлорида кремния парами цинка:
Применение.
Кремний используют в качестве полупроводника. Из него изготовляют, так называемые, солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью.Физические свойства. Кристаллический кремний - вещество темно-серого цвета со стальным блеском. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается. Поэтому в нем имеются свободные электроны, которые обусловливают небольшую электрическую проводимость. При освещении и нагревании увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электрическая проводимость. Так следует объяснять полупроводниковые свойства кремния.
Кремний очень хрупок, его плотность 2,33 г/см 3 . Как и уголь, относится к тугоплавким веществам.
Кремний состоит из трех стабильных изотопов: 28 14 Si (92,27%), 29 14 Si (4,68%) и 30 14 S i (3,05%).
Химические свойства.
По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и +4 (известно соединение кремния, где его степень окисления равна +2).Кремний при обычных условиях довольно инертен, что следует объяснить прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:
![]()
Кислоты (кроме смеси плавиковой
HF и азотной HNO 3 ) на кремний не действуют. Однако он растворяется в гидроксидах щелочных металлов, образуя силикат и водород:Из двух аллотропных модификаций кремния - кристаллической и аморфной - химически более активным является аморфный кремний. Он реагирует с кислородом при нагревании, образуя
SiO 2:![]()
а также со всеми галогенами, например:
![]()
При высокой температуре кремний соединяется с углеродом, образуя карборунд
SiC:![]()
Карборунд имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок к алмазу. Из карбида кремния изготовляют точильные камни и шлифовальные круги.
Силицид магния. В реакциях с активными металлами, протекающих с образованием силицидов, кремний выступает в роли окислителя:
![]()
При высоких температурах кремний восстанавливает многие металлы из их оксидов.
Силан. При действии на силициды соляной кислоты получают простейшее водородное соединение кремния силан
SiH 4: - ядовитый газ с неприятным запахом, самовоспламеняется на воздухе:Оксид кремния
(IV). Оксид кремния (IV) называют также кремнеземом. Это твердое тугоплавкое вещество (температура плавления 1700°С), широко распространенное в природе в двух видах: 1) кристаллический кремнезем - в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности; 2) аморфный кремнезем - в виде минерала опала состава SiO 2× п H 2 O; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получается из метасиликата натрия: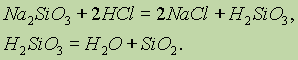
Силикагель имеет развитую поверхность, а поэтому хорошо адсорбирует влагу.
При 1710° кварц плавится. При быстром охлаждении расплавленной массы
образуется кварцевое стекло. Оно имеет очень малый коэффициент расширения, благодаря чему раскаленное кварцевое стекло не трескается при быстром охлаждении водой. Из кварцевого стекла изготовляют лабораторную посуду и приборы для научных исследований. Простейшая формула оксида кремния (IV) SO 2 аналогична формуле оксида углерода (IV) С O 2 . Между тем физические свойства их резко отличаются (SiO 2 - твердое вещество, CO 2 - газ). Это различие объясняется строением кристаллических решеток. С0 2 кристаллизуется в молекулярной решетке, SiO 2 - в атомной. Структуру SiO 2 в плоскостном изображении можно представить так: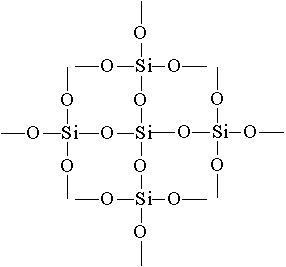
Координационное число атома углерода в твердом С
O 2 равно 2, а кремния в SiO 2 равно 4. Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (SiO 2)n. Такое строение оксида кремния (IV) обусловливает его высокую твердость и тугоплавкость.По химическим свойствам оксид кремния (IV)
SiO 2 относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты: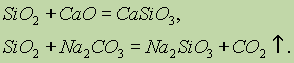
С оксидом кремния (IV) взаимодействует только плавиковая кислота:
С помощью этой реакции производится травление стекла.
В воде оксид кремния (IV) не растворяется и с ней химически не взаимодействует. Поэтому кремниевую кислоту получают косвенным путем, действуя кислотой на раствор силиката калия или натрия:
При этом кремниевая кислота
(в зависимости от концентрации исходных растворов соли и кислоты) может быть получена как в виде студнеобразной массы, содержащей воду, так и в виде коллоидного раствора (золя).Кремниевые кислоты.
SiO 2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой xSiO 2 × yH 2 O, где х и у - целые числа: = 1, у = 1: SiO 2 × H 2 O, т. е. H 2 SiO 3 - метакремниевая кислота;2) х = 1, у = 2: SiO 2 × 2H 2 O, т. е. H 4 SiO 4 - ортокремниевая кислота;
х = 2, у = 1: 2SiO 2 × H 2 O, т. е. H 2 Si 2 O 5 - двуметакремниевая кислота. Кремниевая кислота построена из тетраэдрических структурных звеньев (в каждом таком звене атом кремния находится в центре тетраэдра, а по вершинам расположены атомы кислорода). Структурные звенья, объединяясь в цепи, образуют более устойчивые поликремниевые кислоты: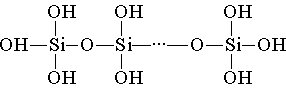
Состав такого соединения можно выразить формулой
(H 2 SiO 3) n . Однако обычно кремниевую кислоту изображают формулой H 2 SiO 3 . H 2 SiO 3 - кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:Все кремниевые кислоты очень слабые (слабее угольной).
Силикаты.
Соли всех кремниевых кислот называют силикатами, хотя, как правило, в учебной литературе под силикатами подразумевают соли метакремниевой кислоты. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO 3 можно выразить так: СаО× SiO 2 .Силикаты состава
R 2 О× nSiO 2 , где R 2 O - оксиды натрия или калия, называются растворимым стеклом, а их концентрированные водные растворы - жидким стеклом. Наибольшее значение имеет натриевое растворимое стекло.При стоянии на воздухе растворы силикатов мутнеют, так как находящийся в воздухе оксид углерода (IV) вытесняет кремниевую кислоту из ее солей:
Кремниевая кислота практически нерастворима в воде - это свойство используют как качественную реакцию на ион
SiO 3 2- .Силикаты получают сплавлением оксида кремния с щелочами или карбонатами:
Применение силикатов.
Наиболее широко используются силикаты натрия и калия. Концентрированные растворы этих солей называют жидким стеклом; они имеют сильнощелочную реакцию вследствие гидролиза. Жидкое стекло используют при изготовлении клея и водонепроницаемых тканей. Жидкое стекло применяется в качестве связующего при изготовлении кислотоупорных бетонов, а также для изготовления замазок, конторского клея. Им пропитывают ткани, дерево и бумагу для придания им огнестойкости и водонепроницаемости.Copyright © 2005-2013 Xenoid v2.0
Использование материалов сайта возможно при условии указания активной ссылки
8.doc
304Кремний. Силан, силициды, Оксид кремния (IV). Кремниевые кислоты, силикаты
8.1. Кремний. Силан, силициды
Кремний - аналог углерода, но его неметаллические свойства выражены слабее, чем у углерода.
Для кремния более характерно sp 3 -гибридное состояние, поэтому в соединениях кремний может проявлять степени окисления 4 и -4.
Кремний - самый распространенный после кислорода элемент на Земле. Массовая доля кремния в земной коре составляет 27,6%. В природе кремний распространен в виде оксида SiO 2 , называемого также кремнеземом, который встречается в виде песка, кварца. Другую группу природных соединений кремния составляют силикаты - производные кремниевой кислоты. Наиболее распространены алюмосиликаты, к которым относятся полевой шпат (альбит) NaAlSi 3 O 8 , полевой шпат (ортоклаз) KAlSi 3 O 8> глина (каолин) Аl 2 О 3 2SiO 2 2Н 2 О, нефелин Na 3 K 4 и др. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных.
Получение
В промышленности кремний получают восстановлением SiO 2 коксом в электрических печах:
SiO 2 2С=S 2CO
В лаборатории в качестве восстановителей используют магний или алюминий:
SiO 2 2Mg=Si 2MgO 3SiO 2 4Al=3Si 2Al 2 O 2
Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200°С: SiCl 4 2Н 2 =Si 4HCl
^ Физические свойства
Кристаллический кремний - вещество темно-серого цвета со стальным блеском. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, которая значительно слабее, чем между атомами углерода в алмазе.
В кристалле кремния даже при обычных условиях часть ковалентных связей разрушается. Поэтому в нем имеются свободные электроны, которые обуславливают небольшую электрическую проводимость. При освещении и нагревании увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электрическая проводимость. Так следует объяснять полупроводниковые свойства кремния. Кремний очень хрупок, его плотность 2,33 г/см 3 . Как и уголь, кремний относится к тугоплавким веществам.
Кремний состоит из трех стабильных изотопов: 28 14 Si(92,27%),
29 14 Si(4,68%) и 30 14 Si(3,05%).
^ Химические свойства
По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, т.к. он имеет больший атомный радиус. Поскольку у атомов кремния на внешнем энергетическом уровне находится 4 электрона, то для кремния характерна степень окисления как -4, так и 4.
Кремний при обычных условиях довольно инертен, что объясняется прочностью его кристаллической решетки. Непосредственно он взаимодействует только со фтором:
Si 2F 2 =SiF 4
Измельченный кремний при нагревании с кислородом сгорает в оксид кремния (IV):
Si О 2 =SiO 2
С хлором кремний реагирует при 400-600°С:
Si 2Сl 2 = SiCl 4
При очень высоких температурах кремний способен непосредственно соединяться с углеродом и азотом:
3Si 2N 2 =Si 3 N 4
Карбид кремния SiC (карборунд) имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода и наоборот, а ковалентные связи очень прочны, как в алмазе. Поэтому по твердости он близок
К алмазу. Из карбида кремния изготавливают точильные камни и шлифовальные круги.
Кислоты (кроме смеси фтороводородной HF и азотной HNO 3) на кремний не действуют. Однако он растворяется в щелочах, образуя силикат и водород:
Si 2NaOH H 2 O=Na 2 SiO 3 2H 2
Кремний с некоторыми металлами - Sn, Al, Zn, Pb, Au, Ag - химически не взаимодействует. С другими же металлами, например с Mg, Ca, Cu, Fe, Pt, Bi, реагирует с образованием силицидов:
2Са Si=Ca 2 Si
Силициды в зависимости от структуры и свойств можно разбить на две группы. К первой относятся силициды щелочных и щелочноземельных металлов (Li 4 Si, Ca 2 Si). Они разлагаются водой и разбавленными кислотами с выделением силанов:
Ca 2 Si 4HCl =2СаСl 2 SiH 4
Наиболее интересна группа металлоподобных силицидов, образованных переходными металлами. В структуре этих силицидов цепи и слои из атомов кремния размещены в кристаллической решетке металла. Это твердые вещества с довольно высокими температурами плавления. Очень важно, что силициды не окисляются даже при высоких температурах. Так, силицид молибдена MoSi 2 не изменяется на воздухе вплоть до 1600°С, что позволяет использовать его как нагреватель электрических печей.
Образование силицидных слоев на металлах широко используется для защиты от окисления и коррозии в различных химических реагентах. Многие силициды являются полупроводниками.
Силан SiH 4 , выделяющийся при действии на силицид соляной кислотой, является ядовитым газом с неприятным запахом. Относится к группе кремневодородов - соединениям кремния с водородом. По строению молекул кремневодороды подобны углеводородам. При комнатной температуре моносилан SiH 4 и дисилан Si 2 H 6 - газообразные вещества, остальные силаны - до последнего известного Si 8 H 18 - летучие жидкости. Они ядовиты и имеют неприятный запах. Химически менее устойчивы, чем углеводороды.
Силаны самовоспламеняются на воздухе:
SiH 4 2O 2 =SiO 2 2Н 2 O
Вода разлагает силаны:
Si 2 H 6 4Н 2 O=2SiO 2 7Н 2
Образованием и дальнейшим разложением SiH 4 пользуются для получения чистого кремния в промышленности полупроводников.
Применение
Кремний используется в качестве полупроводника. Из него изготавливают так называемые солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью.
^ 8.2. Оксид кремния (IV)
Оксид кремния (IV) (кремнезем) - наиболее распространенное в земной коре соединение, составляющее в виде различных минералов 12% ее массы. Различают кристаллический и аморфный кремнезем.
1) ^ Кристаллический кремнезем - в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности.
2) ^ Аморфный кремнезем - в виде минерала опала состава SiO 2 nН 2 О; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получают из метасиликата натрия:
Силикагель имеет развитую поверхность, поэтому хорошо адсорбирует влагу.
Кварц - очень твердое, прочное, тугоплавкое вещество, температура плавления 1723°С. При быстром охлаждении расплавленной массы образуется кварцевое стекло. Из него изготавливают лабораторную посуду и приборы для научных исследований.
Простейшая формула оксида кремния (IV) - SiO 2 . Он кристаллизуется в атомной решетке. Структуру SiO 2 в плоскостном изображении можно представить так:
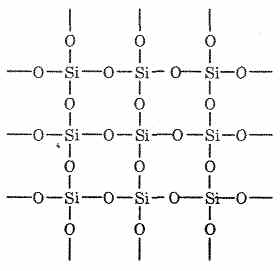
Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (Si0 2) n . Такое строение оксида кремния (IV) обуславливает его высокую твердость и тугоплавкость.
Химические свойства
В воде SiO 2 практически нерастворим. Как кислотный оксид, реагирует при сплавлении с твердыми щелочами, основными оксидами и карбонатами, образуя соли кремниевой кислоты:
SiO 2 2NaOH=Na 2 SiO 3 Н 2 О
SiO 2 CaO=CaSiO 3
SiO 2 Na 2 CO 3 =Na 2 SiO 3 СO 2
Кислоты не действуют на SiO 2 . Лишь фтороводородная кислота постепенно растворяет его:
SiO 2 4HF=SiF 4 2Н 2 O
Эта реакция лежит в основе травления стекла. Накаливание смеси SiO 2 с углеродом до 2000°С приводит к образованию карбида кремния SiC, называемого карборундом: SiO 2 2С=SiC 2CO
Применение
Оксид кремния (IV) широко применяется в силикатной промышленности при производстве стекла, керамики, бетонных изделий, силикатного кирпича. Чистый кварц незаменим в приборостроении. Кристаллы кварца являются пьезоэлектриками - они могут почти без потерь преобразовывать электрическую энергию в механическую. Из мелких кристаллов кварца и из отходов производства пьезоэлектрических пластин получают кварцевое
^ Таблица 26.
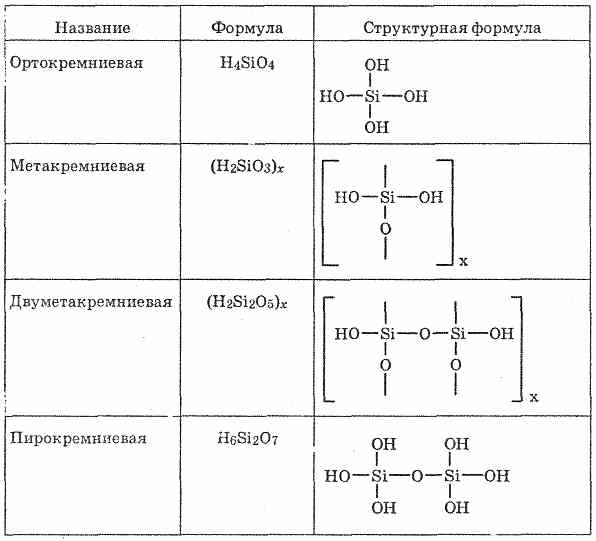
Кремниевые кислоты
Стекло. Оно прозрачно не только для видимого света, но и для ультрафиолетового, обладающего целебным действием.
^ 8.3. Кремниевые кислоты, силикаты
Кремниевые кислоты - соединения оксида кремния (IV) с водой, очень слабые кислоты. Соотношение SiO 2 и Н 2 О в кремниевых кислотах бывает самым различным, поэтому их состав обычно представляют в виде общей формулы «SiO 2 mH 2 O. Кислоты с разными n легко переходят друг в друга. В свободном состоянии выделены Ортокремниевая H 4 SiO 4 , метакремниевая H 2 SiO 3 и несколько других кислот (см. табл. 26).
Кремниевую кислоту получают косвенным путем, действуя. кислотой на силикат калия или натрия:
Na 2 SiO 3 2HCl=2NaCl H 2 SiO 3
Кремниевую кислоту нельзя получить в чистом виде. В водных растворах она образует коллоидный раствор, или золь, который существует очень малый промежуток времени. Золь далее коагулирует, и образуется гель. При высушивании геля образуются продукты с пористой структурой - силикагели, применяемые в качестве осушителей и адсорбентов.
H 2 SiO 3 - кислота очень слабая, в воде малорастворимая. При нагревании легко распадается аналогично угольной кислоте:
H 2 SiO 3 =H 2 O SiO 2
Будучи двухосновной кислотой, диссоциирует ступенчато:
Н 2 SiO 3 Н НSiO - 3
НSiO-3Н SiO 2- 3
Кремниевая кислота слабее угольной.
В водных растворах угольная кислота вытесняет кремниевую из их солей:
Na 2 SiO 3 Н 2 O СО 2 =Na 2 CO 3 H 2 SiO 3
Соли кремниевой кислоты называются силикатами. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO 3 можно выразить так: СаO SiO 2 .
Силикаты обычно нерастворимы в воде. Исключение составляют силикаты натрия и калия, получаемые сплавлением SiO 2 с соответствующими гидроокисями или карбонатами, например:
SiO 2 Na 2 CO 3 =CO 2 Na 2 SiO 3
Водные растворы этих солей называются «жидким стеклом». В результате гидролиза «жидкое стекло» имеет сильнощелочную реакцию. «Жидкое стекло» применяют в качестве связующего при изготовлении кислотоупорных бетонов, а также для изготовления замазок, конторского клея. Им пропитывают ткани, дерево и бумагу для придания им огнестойкости и водонепроницаемости.
Земная кора состоит из оксида кремния (IV) и различных силикатов. Природные силикаты имеют сложный состав и строение. Например:
Полевой шпат K 2 О Аl 2 O 3 6SiO 2 слюда K 2 О 3Аl 2 О 3 6SiO 2 2Н 2 О асбест 3MgO 2SiO 2 2Н 2 О каолинит Аl 2 O 3 2SiO 2 2Н 2 О
Силикаты, содержащие в своем составе оксид алюминия, называются алюмосиликатами. В природе наиболее распространены именно они, например полевые шпаты, а также смеси различ-
Ных силикатов. Так, горные породы - граниты и гнейсы - состоят из кристаллов кварца, полевого шпата и слюды.
Горные породы и минералы на поверхности земли под действием температуры, а затем и углекислого газа выветриваются, т.е. медленно разрушаются.
K 2 О Аl 2 О 3 SiO 2 2Н 2 O СO 2 Аl 2 O 3 2SiO 2 2Н 2 О К 2 СO 3 4SiO 2
Основным продуктом разрушения является минерал каолинит - главная составная часть белой глины. В результате выветривания горных пород образовались залежи глины, песка и солей.
Свойства силикатов бывают довольно различны в зависимости от их состава и строения. Часто силикаты образуют прозрачные и очень красиво окрашенные кристаллы; некоторые из них - драгоценные камни, используемые в ювелирном деле (гранат, топаз, изумруд и др.). Плотность силикатов обычно колеблется от 2 до 4 г/см 3 . Твердость иногда очень невелика (например, у талька), но бывает довольно значительной (например, у циркона ZrSiO 4). При нагревании силикатов они либо плавятся, либо разлагаются в твердом состоянии. Температуры плавления колеблются от 750 до 2000°С, а иногда бывают и выше.
Из искусственных силикатов наибольшее значение имеют стекло, цемент и керамика.
Состав обычного оконного стекла примерно выражают формулой Na 2 O СаО 6SiO 2 . Стекло получают сплавлением в специальных печах смеси соды Na 2 CO 3 , известняка СаСО 3 и белого песка SiO 2 .
SiO 2 Na 2 CO 3 =Na 2 SiO 3 CO 2
SiO 2 CaCO 3 =CaSiO 3 CO 2
Na 2 SiO 3 CaSiO 3 4SiO 2 =Na 2 O CaO 6SiO 2
Для получения специального стекла изменяют состав исходной смеси. Заменяя соду Na 2 CO 3 поташом K 2 СO 3 , получают тугоплавкое стекло (для химической посуды). Заменяя мел CaCO 3 оксидом свинца (II) PbO, а соду поташом, получают хрустальное стекло. Добавки оксидов металлов к исходной смеси придают стеклу различную окраску: оксид хрома (III) Cr 2 O 3 - зеленую, оксид кобальта (II) СоО - синюю, оксид марганца (IV) MnO 2 - красновато-лиловую и т.д.
Стекла при повышении температуры постепенно размягчаются и переходят в жидкое состояние. Обратный процесс осуществляется постепенно - стеклянная масса загустевает по мере остывания. На этом свойстве стекла основано формование из него
Различных изделий. С помощью машин из стеклянной массы вытягивают листовое стекло.
Цемент
Обычный силикатный цемент, или портландцемент, представляет собой зеленовато-серый порошок, который при смешении с водой затвердевает на воздухе (или в воде) в камнеподобную массу. Обычно его получают обжигом (1400-1600°С) до спекания сырьевой смеси, состоящей из известняка и глины.
Из смеси цемента, воды и заполнителей (песок, гравий, щебень, шлак) после затвердевания получают искусственный камень - бетон. Бетон со стальной арматурой называется железобетоном. Бетоны, в которых в качестве вяжущего используются органические полимеры или полимеры совместно с цементом, называются пластбетонами.
Керамика
Керамикой называют материалы и различные изделия, вырабатываемые из природных глин и их смесей с минеральными добавками, а также оксидов и других неорганических соединений, путем формовки, обжига и сушки. Это кирпич, облицовочные плитки, черепица, трубы, глиняная посуда, фарфоровые и фаянсовые изделия.
Производство стекла, цемента и керамики относится к силикатной промышленности, перерабатывающей природные соединения кремния.
Введение
В вашей квартире ремонт, и необходимо купить керамическую плитку. В магазине, долго перебирая различные варианты форм и расцветок, вы нашли подходящую и, направляясь к кассе, мельком взглянули на ту часть упаковки с плиткой, где написан ее состав. Почти все ингредиенты знакомы, но один из них вызвал у вас удивление - оксид кремния. Естественно, вы захотите узнать о нем побольше. Сегодня я постараюсь удовлетворить ваш интерес.
Определение
Кремний имеет переменную валентность, и из-за этого в химии известно два его соединения с кислородом. Сегодня мы рассмотрим высший оксид кремния, в котором последний имеет валентность IV.
Название
В разных источниках его могут обозвать диоксидом кремния, кремнезёмом или оксидом силиция.
Свойства
Он является кислотным оксидом, которому присущи твердость и прочность. Если нагреть его и любую щелочь/основный оксид, то они будут взаимодействовать друг с другом. Это соединение кремния - стеклообразующее, т. е. из него может получиться переохлажденный расплав - стекло.  Также (в чистом виде) он не пропускает электрический ток (является диэлектриком). У оксида кремния атомная кристаллическая решетка. Он является стойким к воздействию кислот, однако исключение составляют плавиковая и газообразный фтороводород. Продукты реакции с последним - фторид кремния и вода. Если же второй реагент - раствор фтороводорода, то ее продуктами будут гексафторкремниевая кислота и та же вода. Если оксид кремния (IV) сплавить с щелочью/основным оксидом/карбонатом любого активного металла, продуктом реакции станет соль кремниевых кислот - силикат, из них растворимы только силикаты калия и натрия. Продукты взаимодействия любого из последних с водой носят название жидкого стекла. У них сильно щелочная среда, причина этому - гидролиз. Гидролизованные силикаты образуют не истинные, а коллоидные растворы. Если растворы силикатов калия или натрия немного окислить, произойдет выпадение студенистого белого осадка, который составляют гидратированные кремниевые кислоты.
Также (в чистом виде) он не пропускает электрический ток (является диэлектриком). У оксида кремния атомная кристаллическая решетка. Он является стойким к воздействию кислот, однако исключение составляют плавиковая и газообразный фтороводород. Продукты реакции с последним - фторид кремния и вода. Если же второй реагент - раствор фтороводорода, то ее продуктами будут гексафторкремниевая кислота и та же вода. Если оксид кремния (IV) сплавить с щелочью/основным оксидом/карбонатом любого активного металла, продуктом реакции станет соль кремниевых кислот - силикат, из них растворимы только силикаты калия и натрия. Продукты взаимодействия любого из последних с водой носят название жидкого стекла. У них сильно щелочная среда, причина этому - гидролиз. Гидролизованные силикаты образуют не истинные, а коллоидные растворы. Если растворы силикатов калия или натрия немного окислить, произойдет выпадение студенистого белого осадка, который составляют гидратированные кремниевые кислоты.
Получение
В промышленности оксид кремния получают, нагревая кремний в кислородной среде. Он окисляется и образует искомый продукт. Также его добывают при помощи термического оксидирования. В лаборатории оксид кремния получают при действии любых кислот на растворимый силикат, для этого подходит даже слабая уксусная. К примеру, если соединить ее и силикат натрия, продуктом реакции станет ацетат натрия и кремниевая кислота. Тут же произойдет разложение последней, и продуктами ее распада станут вода и искомый оксид.
 Применение
Применение
С помощью оксида кремния производят стекло, керамику, абразивы, бетонные изделия, а также получают сам кремний. Еще он выполняет роль наполнителя в отрасли производства резины. Кристаллы аморфной модификации оксида кремния - кварцевого стекла - имеют пьезоэлектрические свойства, и этим пользуются создатели радиотехники, ультразвуковых установок и зажигалок. Силикаты и кремнезёмы - почти 90% массы литосферы. Также оксид кремния известен как пищевая добавка E551. Это его аморфная непористая разновидность. Она предотвращает слеживание и комкование пищи, в фармацевтике используется как вспомогательное вещество и лекарственный препарат-энтеросорбент. Пленки данного оксида служат изолятором, когда производят микросхемы и другие электронные компоненты. Также с их помощью создают волоконно-оптические кабели. А нагревательные элементы электронной сигареты были бы невозможны без кремнезёмной нити.
Заключение
Вот как широко используется данный оксид. И чтобы увидеть его, не нужно бежать в магазин и любопытства ради рассматривать цемент и бетон. Природный оксид кремния находится у нас под ногами - это обыкновенный песок. Оказывается, и он может быть полезным.


