Использование серной кислоты в промышленности кратко. Сырье для производства серной кислоты
100 раствор раствор
0 40 80 20 60 100
Концентрация Концентрация
H2SO4,% SO3(своб.),%
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
СЫРЬЕ ДЛЯ СЕРНОЙ КИСЛОТЫ И МЕТОДЫ ЕЕ
ПОЛУЧЕНИЯ.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является серы. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья (необходимость в этой стадии отпадает при использовании в качестве сырья отходящих газов, так как в этом случае обжиг сульфидов является одной из стадий других технологических процессов). Следующий этап – превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + H2Oà H2SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + H2O à H2SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
КОНТАКТНЫЙ МЕТОД ПОЛУЧЕНИЯ СЕРНОЙ
КИСЛОТЫ.
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы.
Получение H 2 SO 4 из колчедана.
Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы. В зависимости от вида сырья протекают экзотермические химические реакции обжига:
4FeS2 +11O2 = 2Fe2O3 + 8SO2 (I)
S + O2 à SO2 (II)
При протекании реакции (I) помимо газообразного продукта реакции SO2 образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), которая помимо очистки от каталитических ядов включает выделение паров воды (осушку), а также получение побочных продуктов (Se и Te).
Если обжиговый газ получают сжиганием серы, то отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию теплоты.
На третей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы:
SO2 + 1/2O2 ↔ SO3 (III)
Последняя стадия процесса – абсорбция триоксида серы концентрированной серной кислотой или олеумом.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SO2 в SO3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы – снизить выбросы в окружающую среду вредного компонента SO2.
Повышение степени превращения SO2 может быть достигнуто разными путями. Наиболее распространенный из них – создание схем двойного контактирования и двойной абсорбции (ДКДА).
Получение H 2 SO 4 из серы.
Серную кислоту в промышленности производят двумя способами: контактным и нитрозным.
Контактный способ производства серной кислоты.
Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
II. Подготовка сырья.
Производство серной кислоты из пирита FeS 2 .
1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют .
III. Химизм производства .
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое".
Уравнение реакции первой стадии
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe 2 O 3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства - безотходность производства.
Из печи выходит печной газ, состав которого: SO 2 , O 2 , пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO 2 и кислорода О 2 .
ВТОРАЯ СТАДИЯ - окисление SO 2 в SO 3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO 2 + O 2 2SO 3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO 3).
а) температура:
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO 3 является температура 400-500°С . Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V 2 O 5 .
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO 2 и 1V O 2), а справа - 2V SO 3 . Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO 2 и O 2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике , который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO 3 из контактного аппарата. Попадая в контактный аппарат смесь SO 2 и О 2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO 2 в SO 3 . Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO 2 в SO 3 .
Образовавшийся оксид серы SO 3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ - поглощение SO 3 серной кислотой .
Протекает в поглотительной башне.
А почему оксид серы SO 3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO 3 + H 2 O H 2 SO 4 . Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 ·nSO 3 .
Уравнение реакции этого процесса nSO 3 + H 2 SO 4 H 2 SO 4 ·nSO 3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Нитрозный способ производства серной кислоты.
На первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO 2 . Исходным сырьём может быть, в принципе, любое вещество, содержащее серу: природные сульфиды железа (прежде всего, пирит FeS 2), а также сульфиды меди и никеля, сульфидные полиметаллические руды, гипс CaSO 4 . 2H 2 O и элементарные сера. Всё больше и больше используют газы, которые выделяются при переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения серы.
Полученный SO 2 окисляют до H 2 SO 4 , используется для этого в нитрозном методе используется окислы азота. С этой стадии оба метода отличаются друг от друга.
В специальной окислительной башне 3 смешивают окись азота NO и NO 2 с воздухом в таком соотношении, чтобы половина имеющихся NO и NO 2 .
2NO + O 2 → 2 NO 2
В результате газовая смесь содержит равные NO и NO 2 . Она подаётся в башни 4 и 5, орошаемые 75% - ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты:
NO + NO 2 + 2H 2 SO 4 → 2NO( HSO 4) + H 2 O
Раствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда противотоком поступает SO 2 и добавляется вода. В результате гидролизанитрозиллерной кислоты образуется азотная кислота:
NO ( HSO 4) + H 2 O → H 2 SO 4 + HNO 2
Она - то и окисляет SO 2 по уравнению:
SO 2 + 2HNO 2 → H 2 SO 4 + 2 NO
В нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество её меряется с выхлопными газами, приходится добавлять в систему HNO 3 , служащую источником окислов азота.
Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность. Преимущество этого метода в том, что примеси содержащиеся в SO 2 , не влияют на ход процесса, так что исходный SO 2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO 2 , путем обжига FeS 2 , затем SO 3 , после чего на третьей стадии получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде.Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы - увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине “кислых” дождей повреждены памятники архитектуры.
В зоне до 300 км от источника загрязнения (SO 2) опасность представляет серная кислота, в зоне до 600 км. - с ульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб - громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода очистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита - гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течении одной минуты протекают следующие реакции:
F 2 +2NaOH → O 2 +H 2 O+2NaF
HF+NaOH → NaF+H 2 O;
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
2NaF+CaO+H 2 O → CaF 2 +2NaOH
Общие сведения
Серная кислота – один из основных многотоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время, серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.Технологические свойства серной кислоты
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава: n SO 3 . m H 2 O. При n = m = 1 это моногидрат серной кислоты (100%-ная кислота), при m > n – водные растворы моногидрата, при m < n – растворы оксида серы (VI) в моногидрате (олеум):H 2 SO 4 ·(n – 1) SO 3 H 2 SO 4 H 2 SO 4 (m – 1) H 2 O
олеум моногидрат водная кислота Моногидрат серной кислоты – бесцветная маслянистая жидкость с температурой кристаллизации 10,37 о С, температурой кипения 296,2 о С и плотностью 1, 85 г/cм 3 . С водой и оксидом серы (VI) он смешивается во всех отношениях, образуя гидраты состава H 2 SO 4 . Н 2 O; H 2 SO 4 . 2 H 2 O; H 2 SO 4 . 4 H 2 O и соединения с оксидом серы (VI) состава H 2 SO 4 . SO 3 и H 2 SO 4 . 2SO 3 . Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации. Серная кислота смешивается с водой в любых отношениях, при этом выделяется большое количества тепла. По этой причине следует всегда разбавлять серную кислоту, наливая ее в воду, а не наоборот. Эта кислота гигроскопична , т. е. способна поглощать влагу из воздуха. Поэтому ее используют для осушения газов, не реагирующих с нею, пропуская их через серную кислоту.
Применение серной кислоты и олеума
Высокая активность серной кислоты в сочетании со сравнительно небольшой стоимостью производства предопределили громадные масштабы и чрезвычайное разнообразие ее применения. Трудно найти такую отрасль народного хозяйства, в которой не потреблялась бы в тех или иных количествах серная кислота или произведенные из нее продукты. Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в три раза, составляя в настоящее время более 160 млн. т в год. Производство серной кислоты и олеума (в пересчете на моногидрат) в РФ составило: в 1998 г. 5,7 млн. т. Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60%), а также в производстве красителей (от 2 до 16%), химических волокон (от 5 до 15%) и металлургии (от 2 до 3%). При помощи серной кислоты производятся этиловый и другие спирты, некоторые эфиры, синтетические моющие средства, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами. Разбавленные растворы серной кислоты и ее соли применяют в производстве искусственного шелка, в текстильной промышленности для обработки волокна или тканей перед их крашением, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется при получении крахмала, патоки и ряда других продуктов. Транспорт использует свинцовые сернокислотные аккумуляторы. Наконец, серную кислоту применяют в процессах нитрования и при производстве большей части взрывчатых веществ. На рис. 5. представлено применение серной кислоты и олеума в народном хозяйстве.2NOHSO 4 + H 2 O 2H 2 O + N 2 O 3 - Q
Двуокись серы абсорбируется водой и образует сернистую кислоту:
SO 2 + H 2 O H 2 SO 3 + Q
Последняя реагирует с окислами азота в жидкой фазе:
H 2 SO 3 + N 2 O 3 H 2 SO 4 + 2NO + Q
Частично SO 2 может окисляться в газовой фазе:
SO 2 + N 2 O 3 SO 3 + 2NO + Q
SO 3 , абсорбируясь водой, также дает серную кислоту:
SO 3 + H 2 O H 2 SO 4 + Q
Окись азота десорбируется в газовую фазу и окисляется до двуокиси азота кислородом воздуха:
2NO + O 2 2NO 2 + Q
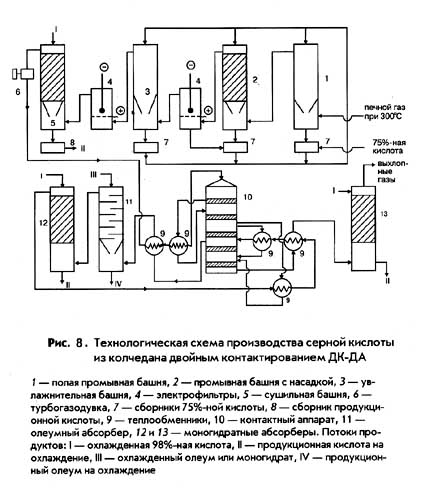
Окислы азота NO + NO 2 N 2 O 3 поглощаются серной кислотой в последующих трех-четырех башнях по реакции, обратной уравнению (а). Для этого в башни подают охлажденную серную кислоту с малым содержанием нитрозы, вытекающую из первых башен. При абсорбции окислов получается нитрозилсерная кислота, участвующая в процессе. Таким образом, окислы азота совершают кругооборот и теоретически не должны расходоваться. На практике же из-за неполноты абсорбции имеются потери окислов азота. Расход окислов азота в пересчете на HNO 3 составляет 10-20 кг на тонну моногидрата H 2 SO 4 . Нитрозным способом получают загрязненную примесями и разбавленную 75-77%-ную серную кислоту, которая используется в основном для производства минеральных удобрений.
Сырье для производства серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы (IV). Природные залежи самородной серы невелики, хотя кларк ее равен 0,1%.Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает. В 1988 году она уже превышала 60% от общего количества серусодержащего сырья. В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты. 1. ЖЕЛЕЗНЫЙ КОЛЧЕДАН. Природный железный колчедан представляет сложную породу, состоящую из сульфида железа FeS 2 , сульфидов других металлов (меди, цинка, свинца, никеля, кобальта и др.), карбонатов металлов и пустой породы. На территории РФ существуют залежи колчедана, на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана.|
|
Общая схема сернокислотного производства
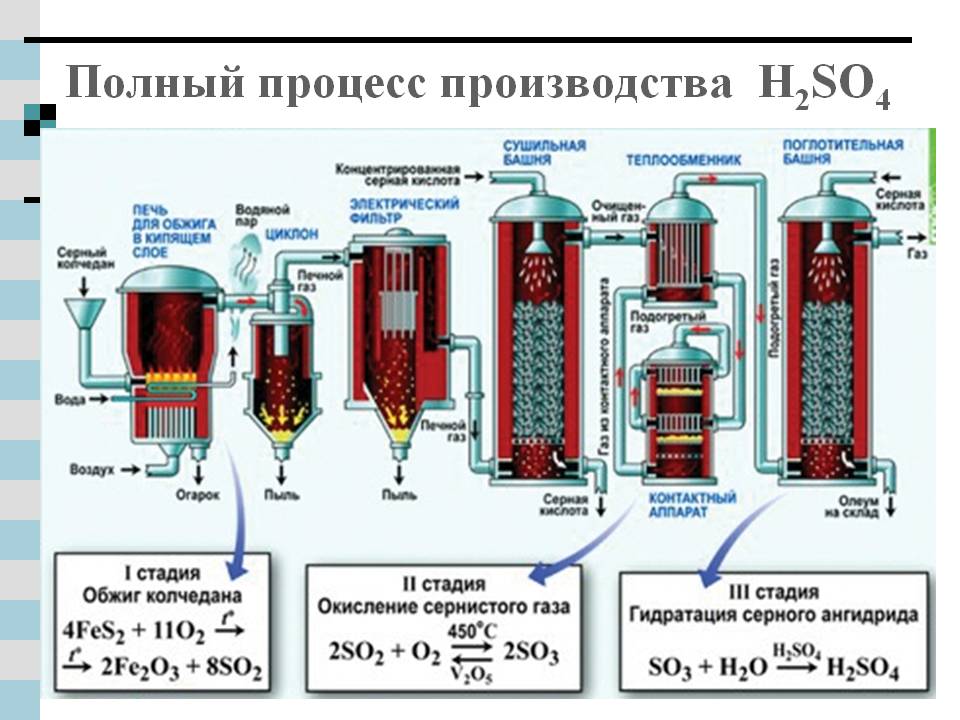
Производство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы: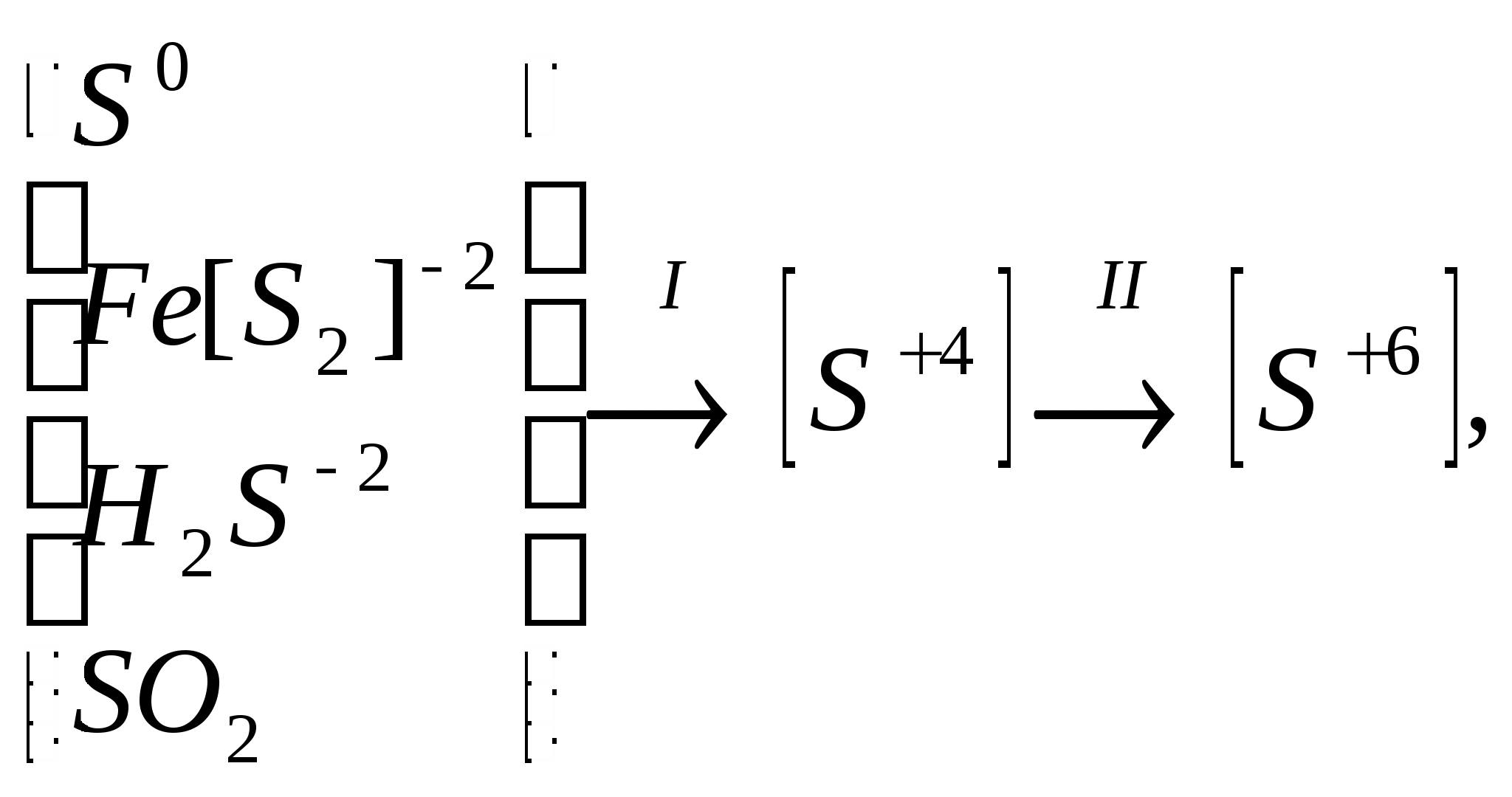
где: I - стадия получения печного газа (оксида серы (IV)) II - стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико-химические операции. В общем случае схема производства серной кислоты может быть выражена в следующем виде:Сырье подготовка сырья сжигание (обжиг) сырья очистка печного газа контактирование абсорбция контактированного газа СЕРНАЯ КИСЛОТА. Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV), наличия или отсутствия стадии абсорбции оксида серы (VI).
Производство серной кислоты из флотационного колчедана
Химическая и принципиальная схемы производства
Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:- окисление дисульфида железа пиритного концентрата кислородом воздуха:4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 ,
Каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
2SO 2 + O 2 = 2SO 3 ,
Абсорбция оксида серы (IV) с образованием серной кислоты:
SO 3 + H 2 O = H 2 SO 4
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
|
|
Окислительный обжиг колчедана
Обжиг колчедана в токе воздуха представляет необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа2FeS 2 = 2FeS + S 2
и окисления продуктов диссоциации:
S 2 + 2O 2 = 2SO 2 ,
4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2 ,
что описывается общим уравнением:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 + 3400 кДж.
Скорость процесса обжига зависит от температуры, дисперсности обжигаемого колчедана. Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30% сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000 o С, так как за этим пределом начинается спекание частиц обжигаемого сырья, что приводит к уменьшению поверхности их и затрудняет омывание частиц потоком воздуха. В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС). Печи кипящего слоя отличаются высокой интенсивностью (до 10000 кг м 2 /сут), обеспечивают более полное выгорание дисульфида железа (содержание серы в огарке не превышает 0,005 мас. долей) и контроль температуры, облегчают процесс утилизации теплоты реакции обжига. К недостаткам печей КС следует отнести повышенное содержание пыли в газе обжига, что затрудняет его очистку. В настоящее время печи КС полностью вытеснили печи других типов в производстве серной кислоты из колчедана. Продукты окислительного обжига колчедана - обжиговый (печной) газ и огарок, состоящий из оксида железа (III), пустой породы и невыноревшего остатка дисульфида железа. На практике, при обжиге колчедана печной газ содержит 13-14% оксида серы(IV), 2% кислорода и около 0,1% оксида серы (VI). Так как в печном газе должен быть избыток кислорода для последующего окисления оксида серы (IV), его состав корректируют, разбавляя воздухом до содержания оксида серы (IV) 7 – 9% и кислорода 11 – 9% .
Очистка обжигового (печного) газа
Обжиговый газ необходимо очистить от пыли, сернокислотного тумана и веществ, являющихся каталитическими ядами или представляющих ценность как побочные продукты. В обжиговом газе содержится до 300 г м 3 пыли, которая на стадии контактирования засоряет аппаратуру и снижает активность катализатора, а также туман серной кислоты. Кроме того, при обжиге колчедана одновременно с окислением дисульфида железа окисляются содержащиеся в колчедане сульфиды других металлов. При этом мышьяк и селен образуют газообразные оксиды As 2 O 3 и SeO 2 , которые переходят в обжиговый газ и становятся каталитическими ядами для ванадиевых контактных масс. Пыль и сернокислотный туман удаляют из обжигового газа в процессе общей чистки газа, которая включает операции механической (грубой) и электрической (тонкой) очистки. Механическую очистку газа осуществляют пропусканием газа через центробежные пылеуловители (циклоны) и волокнистые фильтры, снижающие содержание пыли в газе до 10 – 20 г/м 3 . Электрическая очистка газа в электрофильтрах снижает содержание пыли и тумана в газе до 0,05 – 0,1 г/м 3 . После общей очистки обжиговый газ, полученный из колчедана, обязательно подвергается специальной очистке для удаления остатков пыли и тумана и, главным образом, соединений мышьяка и селена, которые при этом утилизируют. В специальную очистку газа входят операции охлаждения его до температуры ниже температур плавления оксида мышьяка (315 0 С) и селена (340 0 С) в башнях, орошаемых последовательно 50% - ной и 20% - ной серной кислотой, удаления сернокислотного тумана в мокрых электрофильтрах и завершающей осушки газа в скрубберах, орошаемых 95%-ной серной кислотой. Из системы специальной очистки обжиговый газ выходит с температурой 140 – 50С. Оксид селена (IV), извлекаемый из обжигового газа, восстанавливается растворенным в серной кислоте оксидом серы (IV) до металлического селена:SeO 2 + 2SO 2 + 2H 2 O = Se + 2H 2 SO 4 ,
который осаждается в отстойниках. Новым прогрессивным методом очистки обжигового газа является адсорбция содержащихся в нем примесей твердыми поглотителями, например, силикагелем или цеолитами. При подобной сухой очистке обжиговый газ не охлаждается и поступает на контактирование при температуре около 400С, вследствие чего не требует интенсивного дополнительного подогрева.
Контактирование оксида серы (IV )
Реакция окисления оксида серы (IV) до оксида серы (VI), лежащая в основе процесса контактирования обжигового газа, представляет собой гетерогенно-каталитическую, обратимую, экзотермическую реакцию и описывается уравнением:
SO 2 + 0,5 O 2 SO 3 - H.
Тепловой эффект реакции зависит от температуры и равен 96,05 кДж при 25 0 С и около 93 кДж при температуре контактирования. Система «SO 2 – O 2 – SO 3 » характеризуется состоянием равновесия в ней и скоростью процесса окисления оксида серы (IV), от которых зависти суммарный результат процесса. Степень превращения оксида серы (IV) в оксид серы (VI) или степень контактирования, достигаемая на катализаторе, зависит от активности катализатора, температуры, давления, состава контактируемого газа и времени контактирования. От скорости окисления оксида серы (IV) зависит количество оксида серы (IV), окисляющееся в единицу времени, и, следовательно, объем контактной массы, размеры реактора и другие характеристики процесса. Организация этой стадии производства должна обеспечить возможно более высокую скорость окисления при максимальной степени контактирования, достижимой в данных условиях. Энергия активации реакции окисления оксида серы(IV) кислородом в оксид серы (VI) весьма велика. Поэтому, в отсутствии катализатора реакция окисления даже при высокой температуре практически не идет. Применение катализатора позволяет снизить энергию активации реакции и увеличить скорость окисления. В производстве серной кислоты в качестве катализатора применяют контактные массы на основе оксида ванадия (V). Температура зажигания контактных ванадиевых масс составляет 380 – 420 0 С и зависит от состава контактируемого газа, повышаясь с уменьшением содержания в нем кислорода. Контактные массы должны находиться в таком состоянии, чтобы были обеспечены минимальное гидравлическое сопротивление потоку газа и возможность диффузии компонентов через слой катализатора. Для этого контактные массы для реакторов с неподвижным слоем катализатора формуются в виде гранул, таблеток или колец, средним диаметром около 5 мм, а для реакторов кипящего слоя в виде шариков диаметром около 1 мм. Реакторы или контактные аппараты для каталитического окисления оксида серы (IV) по своей конструкции делятся на аппараты с неподвижным слоем катализатора (полочные или фильтрующие), в которых контактная масса расположена в 4-5 слоях, и аппараты кипящего слоя. Отвод тепла после прохождения газом каждого слоя катализатора осуществляется путем введения в аппарат холодного газа или воздуха, или с помощью встроенных в аппарат или вынесенных отдельно теплообменников. К преимуществам контактных аппаратов кипящего слоя относятся:- высокий коэффициент теплоотдачи от катализатора в состоянии кипящего слоя к поверхности теплообменника (в 10 раз больше, чем от газа), что позволяет без перегрева вести контактирование печного газа с высоким содержанием оксида серы (IV) и снизить температуру зажигания катализатора;- нечувствительность к пыли, вносимой вместе с печным газом.
Абсорбция оксида серы (VI )
Последней стадией в производстве серной кислоты контактным способом является абсорбция оксида серы (VI) из контактированного газа и превращение его в серную кислоту или олеум. Абсорбция оксида серы (VI) представляет обратимую экзотермическую реакцию и описывается уравнением:
n SO 3 + H 2 O H 2 SO 4 + (n – 1) SO 3 - H.
Тепловой эффект реакции зависит от значения n и для n = 1 (образование моногидрата серной кислоты) равен 92 кДж. В зависимости от количественного соотношения оксида серы (VI) и воды может быть получен продукт различной концентрации:
- при n
1 олеум, при n
= 1 моногидрат (100%-ная серная кислота), при n
1 водный раствор кислоты (разбавленная серная кислота).
|
|
Товарные сорта серной кислоты
Современная промышленность выпускает несколько сортов серной кислоты и олеума, различающихся концентрацией и чистотой (табл. 2). Чтобы уменьшить возможность кристаллизации продуктов при перевозке и хранении, а также в самом производстве, установлены стандарты (ГОСТ 2184-77) на товарные сорта их, концентрации которых отвечают эвтектическим составам с наиболее низкими температурами кристаллизации.Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы.
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного газа. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы ТЭС и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (4). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
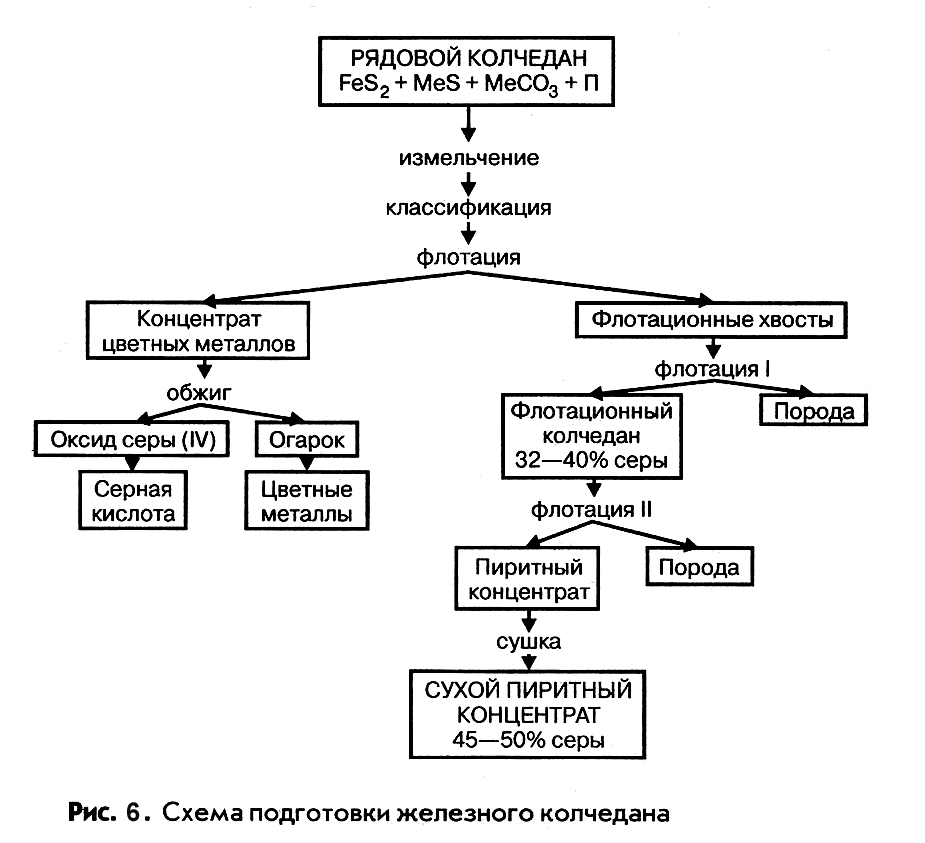
1. Железный колчедан.
Природный железный колчедан представляет сложную породу, состоящую из сульфида железа FеS 2 , сульфидов других металлов (меди, цинка, свинца и др.), карбонатов металлов и пустой породы. В РФ залежи колчедана имеются на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа.
Чистый пирит содержит 53.5% серы и 46.5% железа. В серном колчедане содержание серы обычно колеблется от 35 до 50%, железа от 30 до 40%, остальное составляют сульфиды цветных металлов, углекислые соли, песок, глина и др.
Схема подготовки рядового колчедана представлена на рисунке.
флотация
| ПОРОДА |
| На основе материального баланса рассчитываются расходные коэффициенты, определяются размеры аппаратов и устанавливаются оптимальные значения параметров технологического режима процесса. 2. Сера. Элементарная сера может быть получена из серных руд или газов содержащих сероводород или оксид серы. В соответствии с этим различают серу самородную и серу газовую комовую: Самородная сера руда Газовая сера Н 2 S газы На территории РФ залежей самородной серы практически нет. Источником газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа. Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом. Схема подготовки самородной серы |
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного его окисления над твердым катализатором. При этом протекают реакции:
Н 2 S +1.5О 2 = SО 2 +Н 2 О
2Н 2 S +SО 2 =2Н 2 О + 1.5S 2
2Н 2 S +О 2 = Н 2 О +S 2
3.Сероводород .
Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке газ, содержит до 90% сероводорода и не нуждается в специальной подготовке.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице приведены основные ТЭП производства серной кислоты из различного сырья (за 100% взяты показатели производства на основе железного колчедана).
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу. Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления.
Поэтому производства серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Держинск, Березняки, Пермь.
Конец работы -
Эта тема принадлежит разделу:
Химическая технология
Федеральное государственное образовательное учреждение... высшего профессионального образования... Новгородский государственный университет имени Ярослава Мудрого...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
11. 2 Основные закономерности гомогенных процессов
12.1 Характеристика гетерогенных процессов
12 Гетерогенные процессы
12.1 Характеристика гетерогенных процессов
Окружающая среда
Первоисточник удовлетворения материальных и духовных потребностей человека – природа. Она же представляет и среду его обитания – окружающую среду. В окружающей среде выделяют природ
Производственная деятельность человека и ресурсы планеты
Условием существования и развития человечества является материальное производство, т.е. общественно – практическое отношение человека к природе. Разнообразные и гигантские масштабы промышленного пр
Биосфера и ее эволюция
Окружающая среда – это сложная многокомпонентная система, компоненты которой соединены между собой многочисленными связями.
Окружающая среда состоит из ряда подсистем, каждая из которых вк
Химическая промышленность
По назначению производимой продукции промышленность подразделяется на отрасли, одной из которых является химическая промышленность. Удельный вес химической и нефтехимической отраслей в общем произв
Химическая наука и производство
3.1 Химическая технология – научная основа химического производства
Современное химическое производство представляет многотоннажное, автоматизированное производство, основ
Особенности химической технологии как науки
Химическая технология отличается от теоретической химии не только необходимостью учитывать экономические требования к изучаемому ею производству. Между задачами, целями и содержанием теоретической
Связь химической технологии с другими науками
Химическая технология использует материал целого ряда наук:
Химическое сырье
Сырье – один из основных элементов технологического процесса, который определяет в значительной степени экономичность процесса, выбор технологии.
Сырьемназываются природные материал
Ресурсы и рациональное использование сырья
В себестоимости химической продукции доля сырья достигает 70%. Поэтому весьма актуальна проблема ресурсов и рационального использования сырья при его переработке и добыче. В химической промышленнос
Подготовка химического сырья к переработке
Сырье, предназначенное для переработки в готовую продукцию, должно удовлетворять определенным требованиям. Это достигается комплексом операций, составляющих процесс подготовки сырья к переработке.
Замена пищевого сырья не пищевым и растительного минеральным.
Успехи органической химии позволяют производить ряд ценных органических веществ из разнообразного сырья. Так, например, этиловый спирт, используемый в больших количествах в производстве синтетическ
Использование воды, свойства воды
Химическая промышленность - один из крупных потребителей воды. Вода используется почти во всех химических производствах для разнообразных целей. На отдельных химических предприятиях потребление вод
Промышленная водоподготовка
Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства использования воды. Вс
Использование энергии в химической промышленности
В химической промышленности протекают разнообразные процессы, связанные или с выделением, или с затратой, или с взаимными превращениями энергии. Энергия затрачивается не только на проведение химиче
Основным источником энергии, потребляемой химической промышленностью, являются горючие ископаемые и продукты их переработки, энергия воды, биомасса и ядерное топливо. Энергетическая ценность отдель
Технико-экономические показатели химического производства
Для химической промышленности, как отрасли крупномасштабного материального производства, имеет значение не только технологии, но и тесно связанный с ней экономический аспект, от которого зависит но
Структура экономики химической промышленности
Важное значение для оценки экономической эффективности имеют и такие показатели как капитальные затраты, себестоимость продукции и производительность труда. Эти показатели зависят от структуры экон
Материальные и энергетические балансы химического производства
Исходные данные для всех количественных расчетов, производимых при организации нового производства или оценке эффективности действующего основываются на материальных и энергетических балансах. Эти
Понятие о химико-технологическом процессе
В процессе химического производства исходные вещества (сырье) перерабатываются в целевой продукт. Для этого необходимо осуществить ряд операций, включающих подготовку сырья для перевода его в реакц
Химический процесс
Химические процессы осуществляются в химическом реакторе, представляющем основной аппарат производственного процесса. От конструкции химического реактора и режима его работы зависит эффективность в
Скорость химической реакции
Скорость химической реакции, протекающей в реакторе, описывается общим уравнением:
V = K* L *DC
L-параметр, характеризующий состояние реагирующей системы;
К- конст
Общая скорость химического процесса
Поскольку для гетерогенных систем процессы в зонах реактора 1, 3 и 2 подчиняются различным законам, они протекают с различной скоростью. Общая скорость химического процесса в реакторе определяется
Термодинамические расчеты химико-технологических процессов
При проектировании технологических процессов очень важны термодинамические расчеты химических реакций. Они позволяют сделать заключение о принципиальной возможности данного химического превращения,
Равновесие в системе
Выход целевого продукта химического процесса в реакторе определяется степенью приближения реакционной системы к состоянию устойчивого равновесия. Устойчивое равновесие отвечает следующим условиям:
Расчет равновесия по термодинамическим данным
Расчет константы равновесия и изменение энергии Гиббса позволяет определять равновесный состав реакционной смеси, а также и максимально возможное количество продукта.
В основе расчета конс
Термодинамический анализ
Знание законов термодинамики необходимо инженеру не только для проведения термодинамических расчетов, но и для оценки энергетической эффективности химико-технологических процессов. Ценность анализа
Химическое производство как система
Производственные процессы в химической промышленности могут существенно различаться видами сырья и продукции, условиям их проведения, мощностью аппаратуры и т. д. Однако при всем многообразии конкр
Моделирование химико-технологической системой
Проблема масштабного перехода от лабораторного эксперимента к промышленному производству при проектировании последнего решается методом моделирования. Моделированием называется метод исследовани
Выбор схемы процесса
Организация любого ХТП включает следующие стадии:
– разработку химической, принципиальной и технологической схем процесса;
– выбор оптимальных технологических параметров и установ
Выбор параметров процесса
Параметры ХТП выбираются так, чтобы обеспечить максимально высокую экономическую эффективность не отдельной его операции, а всего производства в целом. Так, например, для рассмотренного выше произв
Управление химическим производством
Сложность химического производства как многофакторной и многоуровневой системы, приводит к необходимости использовать в нем разнообразные системы управления отдельными производственными процессами,
Гидромеханические процессы
Гидромеханическими процессами называются процессы, протекающие в гетерогенных, минимум двухфазных системах и подчиняющихся законам гидродинамики. Подобные системы состоят из дисперсной фазы,
Тепловые процессы
Тепловыми называются процессы, скорость протекания которых определяется скоростью подвода или отвода тепла. В тепловых процессах принимают участие минимум две среды с различными температурами, прич
Массообменные процессы
Массообменными называются процессы, скорость которых определяется скоростью переноса вещества из одной фазы в другую в направлении достижения равновесия (скоростью массопередачи). В процессе массоо
Принципы проектирования химических реакторов
Главная стадия химико-технологического процесса, определяющая его назначение и место в химическом производстве, реализуется в основном аппарате химико-технологической схемы, в котором протекает хим
Конструкции химических реакторов
Конструктивно химические реакторы могут иметь различную форму и устройство, т.к. в них осуществляется разнообразные химические и физические процессы, протекающие в сложных условиях массо-и теплопер
Устройство контактных аппаратов
Химические реактора для проведения гетерогенно–каталитических процессов называются контактными аппаратами. В зависимости от состояния катализатора и режима его движения в аппарате, они делятся на:
Характеристика гомогенных процессов
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встре
Гомогенные процессы в газовой фазе
Гомогенные процессы в газовой фазе широко применяются в технологии органических веществ. Для осуществления этих процессов органическое вещество испаряется, и затем его пары обрабатываются тем или и
Гомогенные процессы в жидкой фазе
Из большого числа процессов, идущих в жидкой фазе, можно отнести к гомогенным процессы нейтрализации щелочи в технологии минеральных солей без образования твердой соли. Например, получение сульфата
Основные закономерности гомогенных процессов
Гомогенные процессы, как правило, идут в кинетической области, т.е. общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и
Характеристика гетерогенных процессов
Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения
Процессы в системе газ- жидкость (Г-Ж)
Процессы, основанные на взаимодействии газообразных и жидких реагентов, широко используются в химической промышленности. К таким процессам относятся абсорбция и десорбция газов, испарение жидкостей
Процессы в бинарных твердых, двухфазных жидких и многофазных системах
К процессам, идущим с участием только твердых фаз (Т-Т), обычно относят спекание твердых материалов при их обжиге.
Спекание– это получение твердых и пористых кусков из мелких порошк
Высокотемпературные процессы и аппараты
Повышение температуры влияет на равновесие и скорость химико-технологических процессов, происходящих как в кинетической, так и в диффузионной области. Поэтому регулирование температурного режима пр
Сущность и виды катализа.
Катализом называется изменение скорости химических реакций или их возбуждение в результате воздействия веществ-катализаторов, которые, участвуя в процессе, остаются по окончании его химически не
Свойства твердых катализаторов и их изготовление
Промышленные твердые катализаторы представляют собой сложную смесь, которая называется контактной массой. В контактной массе одни вещества являются собственно катализатором, а другие служат активат
Аппаратурное оформление каталитических процессов
Аппараты гомогенного катализа не имеют каких-либо характерных особенностей, проведение каталитических реакций в однородной среде технически легко осуществимо и не требует аппаратов специальн
Важнейшие химические производства
В н.в. известно свыше 50000 индивидуальных неорганических и около трех миллионов органических веществ. В производственных условиях получают лишь незначительную часть открытых веществ. Собственно
Применение
Высокая активность серной кислоты в сочетании со сравнительно небольшой стоимостью производства предопределило большие масштабы и чрезвычайное разнообразие ее применения.
Среди минеральных
Технологические свойства серной кислоты
Безводная серная кислота (моногидрат) Н2SО4 представляет собой тяжелую маслянистую жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества
Способы получения
Еще в 13 веке серную кислоту получали термическим разложением железного купороса FеSО4, поэтому и сейчас один из сортов серной кислоты называют купоросным маслом, хотя давно уже серная к
Контактный способ производства серной кислоты
Контактным способом производится большое количесвто серной кислоты, воом числе оллеум.
Контактный способ включает три стадии: 1) очистку газа от вредных для катализатора примесей; 2) конта
Производство серной кислоты из серы
Сжигание серы происходит значительно проще и легче, чем обжиг колчедан.
Технологический процесс производства серной кислоты из элементарной серы отличается от процесса производства
Технология связанного азота
Газообразный азот представляет собой одно из самых устойчивых химических веществ. Энергия связи в молекуле азота составляет 945 кДж/моль; он обладает одной из самых высоких энтропий в расчете на а
Сырьевая база азотной промышленности
Сырьем для получения продуктов в азотной промышленности являются атмосферный воздух и различные виды топлива. Одной из составных частей воздуха является азот, который используется в процессах полу
Получение технологических газов
Синтез-газ из твердого топлива. Первым из основных источников сырья для получения синтез-газа явилось твердое топливо, которое перерабатывалось в газогенераторах водяного газа по следующим р
Синтез аммиака
Рассмотрим элементарную технологическую схему современного производства аммиака при среднем давлении производительностью 1360 т/сутки. Режим ее работы характеризуется следующими параметрами: темпер
Типовые процессы солевой технологии
Большинство МУ представляет различные минеральные соли или твердые вещества с подобными солям свойствами. Технологические схемы производства МУ весьма разнообразны, но, в большинстве случаев, склад
Разложение фосфатного сырья и получение фосфорных удобрений
Природные фосфаты (апатиты, фосфориты) используют в основном для получения минеральных удобрений. Качество полученных фосфорных соединений оценивают по содержанию в них Р2О5
Производство фосфорной кислоты
Экстракционный методпроизводства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложение фосфатов и фильтровании образо
Производство простого суперфосфата
Сущность производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат
Производство двойного суперфосфата
Двойной суперфосфат - концентрированное фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он содержит 42-50% усвояемого Р2О5, в том числе в в
Азотнокислотное разложение фосфатов
Получение сложных удобрений.
Прогрессивным направлением в переработке фосфатного сырья является применение метода азотнокислотного разложения апатитов и фосфоритов. Этот метод позв
Производство азотных удобрений
Важнейшим видом минеральных удобрений являются азотные: аммиачная селитра, карбамид, сульфат аммония, водные растворы аммиака и др. Азоту принадлежит исключительно важная роль в жизнедеятельности
Производство аммиачной селитры
Аммиачная селитра, или нитрат аммония, NH4NO3 - кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и нитратной формах, обе формы азота легко усваиваютс
Производство карбамида
Карбамид (мочевина) среди азотных удобрений занимает второе место по объему производства после аммиачной селитры. Рост производства карбамида обусловлен широкой сферой его применения в сельском
Производство сульфата аммония
Сульфат аммония(NН4)2SО4 – бесцветное кристаллическое вещество, содержит 21.21% азота, при нагревании до 5130С полностью разлагается на
Производство нитрата кальция.
Свойства
Нитрат кальция (известковая или кальциевая селитра) образует несколько кристаллогидратов. Безводная соль плавится при температуре 5610С, однако уже при 5000
Производство жидких азотных удобрений
Наряду с твердыми удобрениями применяются и жидкие азотные удобрения, представляющие собой растворы аммиачной селитры, карбамида, кальциевой селитры и их смесей в жидком аммиаке или в концентрирова
Общая характеристика
Больше 90% добываемых из недр земли и вырабатываемых заводскими методами калийных солей используют в качестве удобрений. Калийные минеральные удобрения представляют собой природные или синтетически
Получение хлористого калия
Флотационный способ производства
Флотационный способ выделения хлорида калия из сильвинита основан на флотогравитационном разделении водорастворимых минералов калийной руды в среде
Типовые процессы технологии силикатных материалов
В производстве силикатных материалов используются типовые технологические процессы, что обусловлено близостью физико-химических основ их получения. В самом общем виде производство любого силикатног
Производство воздушной извести
Воздушной или строительной известью называется бессиликатный вяжущий материал на основе оксида и гидроксида кальция. Различают три вида воздушной извести:
-кипелка (негашен
Процесс производства стекла
Сырьем для производства стекол служат разнообразные природные и синтетические материалы. По их роли в образовании стекла, они делятся на пять групп:
1.Стеклообразователи, создающие основу
Производство огнеупоров
Огнеупорными материалами (огнеупорами) называют неметаллические материалы, характеризующиеся повышенной огнеупорностью, т.е. способностью противостоять, не расплавляясь, воздействию высоких темпера
Электролиз водных растворов хлористого натрия
При электролизе водных растворов хлористого натрия получают хлор, водород и едкий натр (каустическая сода).
Хлор при атмосферном давлении и обычной температуре газ желто-зеленого цвета с у
Электролиз раствора хлористого натрия в ваннах со стальным катодом и графитовым анодом
Электролиз раствора хлористого натрия в ваннах со стальным катодом и графитовым анодом дает возможность получать едкий натр, хлор и водород в одном аппарате (электролизере). При прохождении постоян
Электролиз растворов хлористого натрия в ваннах с ртутным катодом и графитовым анодом дает возможность получать более концентрированные продукты, чем в ваннах с диафрагмой.
При пропускании
Производство соляной кислоты
Соляная кислота представляет собой раствор хлористого водорода в воде.
Хлористый водород – это бесцветный газ, имеющий температуру плавления –114.20С и температуру кипения –85
Электролиз расплавов. Производство алюминия
При электролизе водных растворов могут получаться только вещества, потенциал выделения которых на катоде более положителен, чем потенциал выделения водорода. В частности, такие электроотрицательные
Производство глинозема
Сущность производства глинозема заключается в отделении гидроокиси алюминия от других минералов. Это достигается применением ряда сложных технологических приемов: перевод глинозема в растворимую со
Производство алюминия
Производство алюминия осуществляется из глинозема, растворенного в криолите Nа3АlF6. Криолит, как растворитель глинозема, удобен потому, что он достаточно хорошо растворяет Аl
Металлургия
Металлургия – наука о способах получения металлов из руд и другого сырья и отрасль промышленности, производящая металлы. Металлургическое производство возникло в глубокой древности. Еще на заре раз
Руды и способы их переработки
Сырье в производстве металлов – металлические руды. За исключением небольшого числа (платина, золото, серебро) металлы находятся в природе в виде химических соединений, входящих в состав металличес
Производство чугуна
Сырьем для производства чугуна служат железные руды, подразделяющиеся на четыре группы:
Руды магнитной окиси железа или магнитные железняки, содержат 50-70% железа и состоят в основ
Производство меди
Медь – металл, получивший широкое распространение в технике. В чистом виде медь имеет светло-розовый цвет. Температура плавления ее 10830С, температура кипения 23000С, она хор
Химическая переработка топлива
Топливом называют существующие в природе или искусственно изготовленные горючие органические вещества, являющиеся источником тепловой энергии и сырьем для химической промышленности. По природе проц
Коксование каменных углей
Коксование – метод переработки топлив, преимущественно углей, заключающийся в нагревании их без доступа воздуха до 900-10500С. Топливо при этом разлагается с образованием с образованием
Производство и переработка газообразного топлива
Газообразным топливом называется топливо, находящееся в состоянии газа при температуре и давлении его эксплуатации. По происхождению газообразное топливо подразделяется на природное и синтетическое
Основной органический синтез
Основным органическим синтезом (ООС) называется совокупность производств органических веществ относительно простого строения, вырабатываемых в очень больших количествах и используемых в качестве це
Сырье и процессы ООС
Производство продуктов ООС базируется на ископаемом органическом сырье: нефти, природном газе, каменном угле и сланцах. В результате разнообразных химических и физико-химических пре
Синтезы на основе оксида углерода и водорода
Органический синтез на основе оксида углерода и водорода получил широкое промышленное развитие.
Каталитический синтез углеводородов из СО и Н2 впервые осуществлен Сабатье, синт
Синтез метилового спирта
Метиловый спирт (метанол) в течение длительного времени получали из надсмольной воды, выделяющейся при сухой перегонке древесины. Выход спирта при этом зависит от породы древесины и колеблется от 3
Производство этанола
Этанол- бесцветная подвижная жидкость с характерным запахом, температура кипения 78.40С, температура плавления –115.150С, плотность 0.794 т/м3. Этанол смешивается в
Производство формальдегида
Формальдегид (метаналь, муравьиный альдегид) – бесцветный газ с острым раздражающим запахом, с температурой кипения-19.20С, температурой плавления –1180С и плотностью (в жидко
Получение карбамидо-формальдегидных смол.
Типичными представителями искусственных смол являются мочевино-формальдегидные смолы, которые образуются в результате реакции поликонденсации, протекающей при взаимодействии молекул мочевины и форм
Производство ацетальдегида
Ацетальдегид (этаналь, укс
Производство уксусной кислоты и ангидрида
Уксусная кислота (этановая кислота) представляет собой бесцветную жидкость с резким запахом, с температурой кипения 118.10С, температурой плавления 16.750С и плотностью
Полимеризационные мономеры
Мономерами называются низкомолекулярные соединения преимущественно органической природы, молекулы которых способны вступать в реакцию друг с другом или с молекулами других соединений с образованием
Производство поливинилацетатной дисперсии
В СССР промышленное производство ПВАД впервые осуществлено в 1965г. Основным способом получения ПВАД в СССР являлся неперывно-каскадный, однако, имелись производства, в которых был принят периодиче
Высокомолекулярные соединения
Большое значение в народном хозяйстве имеют природные и синтетические высокомолекулярные органические соединения: целлюлоза, химические волокна, каучуки, пластмассы, резина, лаки, клеи и т.д. Как п
Производство целлюлозы
Целлюлоза – один из основных видов полимерных материалов. Более 80% древесины, идущей для химической переработки, используется для получения целлюлозы и древесной массы.
Целлюлоза, иногда
Производство химических волокон
Волокнами называют тела, длина которых во много раз превышает их очень малые размеры поперечного сечения, обычно измеряемого микронами. Волокнистые материалы, т.е. вещества, состоящие из волокон, и
Производство пластических масс
К пластмассам относят обширную группу материалов, главной составной частью которых являются природные или синтетические ВМС, способные при повышенной температуре и давлению переходить в пластическо
Получение каучука и резины
К каучукам относят эластичные ВМС, способные под влиянием внешних сил значительно деформироваться и быстро возвращаться в исходное состояние после снятия нагрузки. Упругие свойства
1. Введение
2. Общая характеристика установки производства серной кислоты
3. Сырьевые источники получения серной кислоты
4.Краткое описание промышленных способов получения серной кислоты
5.Выбор катализатора
6. Обоснование способа производства
7. Стадии и химизм процесса
8. Термодинамический анализ
9. Кинетика процесса окисления SO 2
10. Конденсация серной кислоты
11. Термодинамический анализ процесса конденсации
12. Описание технологической схемы процесса
13. Расчет материального баланса
14. Расчет теплового баланса
15. Расчет контактного аппарата
16. Меры безопасности при эксплуатации производственного объекта
17. Список литературы
1. Введение
Серная кислота - один из основных многотоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время, серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава: п SО 3 · т Н 2 О.
Моногидрат серной кислоты - бесцветная маслянистая жидкость с температурой кристаллизации 10,37 о С, температурой кипения 296,2 о С и плотностью 1,85 т/м 3 . С водой и оксидом серы (VI) он смешивается во всех отношениях, образуя гидраты состава Н 2 SО 4 · Н 2 О, Н 2 SО 4 · 2Н 2 О, Н 2 SО 4 · 4Н 2 О и соединения с оксидом серы Н 2 SО 4 · SО 3 и Н 2 SО 4 ·2SО 3 .
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации.
Температура кипения серной кислоты также зависит от ее концентрации, то есть состава системы "оксид серы (VI) - вода". С повышением концентрации водной серной кислоты температура ее кипения возрастает и достигает максимума 336,5 о С при концентрации 98,3 %, что отвечает азеотропному составу, а затем снижается. Температура кипения олеума с увеличением содержания свободного оксида серы (VI) снижается от 296,2 о С (температура кипения моногидрата) до 44,7 о С, отвечающей температуре кипения 100 %-ного оксида серы (VI).
При нагревании паров серной кислоты выше 400 о С она подвергается термической диссоциации по схеме:
400 о С 700 о С
2 Н 2 SО 4 <=> 2Н 2 О + 2SО 3 <=> 2Н 2 О + 2SО 2 + О 2 .
Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в три раза и составляет в настоящее время более 160 млн. т в год.
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), а также в производстве красителей (от 2 до 16 %), химических волокон (от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности.
2. Общая характеристика установки производства серной кислоты
Установка предназначена для получения технической серной кислоты из сероводородсодержащего газа. Сероводородный газ поступает с установок гидроочистки, блока сероочистки газов, установки регенерации амина и отпарки кислых стоков.
Ввод установки в эксплуатацию - 1999 г.
Установка производства серной кислоты рассчитана на переработку 24 тыс. тонн в год сероводородсодержащего газа.
Проектная производительность установки по серной кислоте составляет 65 тыс. тонн в год.
Проект установки выполнен ОАО "ВНИПИнефть" на основании технологии датской фирмы "Хальдор Топсе АС" и ОАО "НИУИФ" г. Москва.
Российская часть установки представлена секцией подготовки сырья, котлами-утилизаторами КУ-А,В,С сжигания сероводородсодержащего газа, блоками деаэрации обессоленной воды, нейтрализации сернокислотных сбросов и обеспечения установки воздухом КИП.
Датской стороной предоставлен блок WSA в составе:
· контактного аппарата (конвертера);
· конденсатора;
· системой циркуляции и откачки серной кислоты;
· системой воздуходувок подачи воздуха на сжигание H 2 S, охлаждения и разбавления технологического газа;
· системой подачи силиконового масла (блок управления кислотными парами) в технологический газ с целью снижения выбросов SO x в атмосферу.
3. Сырьевые источники получения серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов метало, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
4. Краткое описание промышленных способов получения серной кислоты
Производство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:
где I – стадия получения печного газа (оксида серы (IV)),
II – стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико-химические операции.
В общем случае производство серной кислоты может быть выражено в следующем виде:
Сырье подготовка сырья сжигание (обжиг) сырья
очистка печного газа контактирование абсорбция
контактированного газа СЕРНАЯ КИСЛОТА
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV), наличия или отсутствия стадии абсорбции оксида серы (VI).
В зависимости от того, как осуществляется процесс окисления SО 2 вSО 3 , различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SО 2 вSО 3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SО 3 + Н 2 О Н 2 SО 4
При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SО 3 + N 2 О 3 + Н 2 О Н 2 SО 4 + 2NО
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
1) Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
Окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS 2 + 11О 2 = 2Fе 2 S 3 + 8SО 2 ,
Каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
2SО 2 + О 2 2SО 3
Абсорбция оксида серы (VI) с образованием серной кислоты:
SО 3 + Н 2 О Н 2 SО 4
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
2) Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей. К ним относятся:
– особая конструкция печей для получения печного газа;
– повышенное содержание оксида серы (IV) в печном газе;
– отсутствие стадии предварительной очистки печного газа.
Последующие операции контактирования оксида серы (IV) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме ДКДА. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора
3) Существует также способ производства серной кислоты из сероводорода, получивший название "мокрого" катализа, состоит в том, что смесь оксида серы (IV) и паров воды, полученная сжиганием сероводорода в токе воздуха, подается без разделения на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии:
1. Сжигание сероводорода:
Н 2 S + 1,5О 2 = SО 2 + Н 2 О
с образованием смеси оксида серы (IV) и паров воды эквимолекулярного состава (1: 1).
2. Окисление оксида серы (IV) до оксида серы (VI):
SО 2 + 0,5О 2 <=> SО 3
с сохранением эквимолекулярности состава смеси оксида серы (IV) и паров воды (1: 1).
3. Конденсация паров и образование серной кислоты:
SО 3 + Н 2 О <=> Н 2 SО 4
таким образом, процесс мокрого катализа описывается суммарным уравнением:
Н 2 S + 2О 2 = Н 2 SО 4
Существует схема получения серной кислоты при повышенном давлении. Влияние давления на скорость процесса возможно оценить в кинетической области, где практически отсутствует влияние физических факторов. Повышение давления влияет как на скорость процесса, так и на состояние равновесия. Скорость реакции и выход продукта с повышением давления увеличиваются за счет повышения действующих концентраций SO 2 и О 2 и увеличения движущей силы процесса. Но при увеличении давления так же возрастают производственные затраты на сжатие инертного азота. Так же увеличивается температура в контактном аппарате, т.к. при высоком давлении и невысокой температуре значение константы равновесия мало, по сравнению со схемой под атмосферным давлением.
Большие масштабы производства серной кислоты особенно остро ставят проблему его совершенствования. Здесь можно выделить следующие основные направления:
1. Расширение сырьевой базы за счет использования отходящих газов котельных теплоэлектроцентралей и различных производств.
2. Повышение единичной мощности установок. Увеличение мощности в два-три раза снижает себестоимость продукции на 25 – 30%.
3. Интенсификация процесса обжига сырья путем использования кислорода или воздуха, обогащенного кислородом. Это уменьшает объем газа, проходящего через аппаратуру, и повышает ее производительность.
4. Повышение давления в процессе, что способствует увеличению интенсивности работы основной аппаратуры.
5. Применение новых катализаторов с повышенной активностью и низкой температурой зажигания.
6. Повышение концентрации оксида серы (IV) в печном газе, подаваемом на контактирования.
7. Внедрение реакторов кипящего слоя на стадиях обжига сырья и контактирования.
8. Использование тепловых эффектов химических реакций на всех стадиях производства, в том числе, для выработки энергетического пара.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SО 2 в SО 3 . Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы – снизить выбросы в окружающую среду вредного компонента SО 2 .
Для решения этой проблемы велось много различных исследований в различных областях: абсорбция SO 2 , адсорбция, исследования в изменении конструкции контактного аппарата.
Существую различные конструкции контактных аппаратов:
Контактный аппарат с одинарным контактированием: такой аппарат характеризуется невысокой степенью превращения диоксида серы в триоксид. Недостаток этого аппарата заключается в том, что газ, выходящий из контактного аппарата, имеет высокое содержание диоксида серы, что отрицательно сказывается с экологической точки зрения. Используя данный аппарат, отходящие газы необходимо очистить от SO 2 . Для утилизации SO 2 существует много различных способов: абсорбция, адсорбция,…. Это, конечно, снижает количество выбросов SO 2 в атмосферу, но это увеличивает, в свою очередь, количество аппаратов в технологическом процессе, высокое содержание SO 2 в газе после контактного аппарата показывает низкую степень использования SO 2 , поэтому данные аппараты в производстве серной кислоты не используюися.
Контактный аппарат с двойным контактированием: ДК позволяет достичь того же минимального содержания SO 2 в выхлопных газах, что и после химической очистки. Метод основан на известном принципе Ле-Шателье, согласно которому удаление одного из компонентов реакционной смеси сдвигает равновесие в сторону образования этого компонента. Сущность метода заключается в проведении процесса окисления диоксида серы с выделением триоксида серы в дополнительном абсорбере. Метод ДК позволяет перерабатывать концентрированные газы.
Контактный аппарат с промежуточным охлаждением. Сущность метода заключается в том, что газ, поступающий в контактный аппарат, пройдя через слой катализатора, попадает в теплообменник, там газ охлаждается, затем поступает на следующий слой катализатора. Этот метод так же увеличивает степень использования SO 2 и содержание его в выхлопных газах.
5 . Выбор катализатора
Наиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа - 7% SO2 и 11% О2 она проявляет каталитическую активность только при температурах выше 625 оС, т.е. когда хр 70%, и поэтому применялась лишь для начального окисления SO2 до достижения хр 50-60%. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7% V2O5; активаторами являются окислы щелочных металлов, обычно применяют активатор К2О; носителем служат пористые алюмосиликаты. В настоящий момент катализатор применятся в виде соединения SiO2, K и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия "ванадий - содержащий". Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того - такой катализ дешевле нежели калий/ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца.
6. Обоснование способа производства
Получение серной кислоты из сероводорода (мокрый катализ) на Пермском нефтеперерабатывающем заводе является малотоннажным производством (65тыс. тонн в год). В основном, это производство создано для того, чтобы снизить выбросы серосодержащих газов и максимально перерабатывать сырье, которое в данном случае является отходом процесса гидроочистки нефти.
Помимо использования сероводорода, в процессе получения серной кислоты протекают 3 реакции:
Н 2 S + 1,5О 2 = SО 2 + Н 2 О
SО 2 + 0,5О 2 <=> SО 3
SО 3 + Н 2 О <=> Н 2 SО 4
Эти три реакции протекают с выделением значительного количества тепла, которое используется для различных нужд цеха производства серной кислоты и в различных целях предприятия: получение пара, который используется в данном производстве, получение пара высокого давления, который используют другие установки, подогрев воздуха, поступающий в котлы для сжигания сероводорода и в контактный аппарат.
Преимущество получения серной кислоты из сероводорода заключается в том, что данный процесс максимально использует и сероводород, и диоксид серы, что в значительной мере снижает выбросы в атмосферу, при проведении процесса, состоящего из 3 реакций, используются невысокие температуры и атмосферное давление, что значительно снижает энергозатраты по сравнению со схемой, которая применяет высокое давление. С учетом того, что в результате технологического процесса выделяется большое количество тепла, процесс, благодаря этому, протекает автотермично.
7. Стадии и химизм процесса
Процесс получения серной кислоты методом "мокрого" катализа состоит из следующих основных стадий.
1. Получение сернистого ангидрида (SO 2) путем сжигания сероводородсодержащего газа по следующей реакции:
2H 2 S+ 3O 2 = 2SO 2 + 2 H 2 O
2. Охлаждение дымовых газов и утилизация тепла реакции горения сероводорода в котле-утилизаторе с получением водяного пара.
3. Окисление сернистого ангидрида до серного ангидрида (SO 3) на ванадиевом катализаторе в контактном аппарате (конвертере) R-104 по следующей реакции:
2SO 2 + O 3 = 2 SO 3
4. Получение серной кислоты (H 2 SO 4) путем конденсации в конденсаторе WSA У-109 по реакции:
SO 3 + H 2 O= H 2 SO 4
5. Для получения улучшенной серной кислоты (содержание окислов азота N 2 O 3 менее 0,5 ppm) предусмотрена схема подачи гидразингидрата в поток серной кислоты, поступающей на участок концентрирования серной кислоты.
Гидразинсульфат, полученный при добавлении гидразина к серной кислоте, взаимодействует с нитрозилсернистой кислотой, обуславливающей содержание N 2 О 3 в продуктовой кислоте:
4NOSO 3 H+ N 2 H 4 · H 2 SO 4 3N2 + 5H 2 SO 4
Избыток гидразина окисляется с образованием элементарного азота:
N 2 H 4 · H 2 SO 4 + O 2 N2 +2H 2 O + H 2 SO 4
Химическийсостав серной кислоты выражается формулой H 2 SO 4 . Структурная формула серной кислоты выглядит следующим образом:
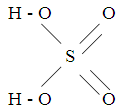
Относительная молекулярная масса серной кислоты - 98,08 кг/кмоль.
Безводная серная кислота содержит 100 % H 2 SO 4 или 81,63 % SO 3 и 18,37 % мас. H 2 O. Это бесцветная маслянистая жидкость не имеющая запаха с температурой кристаллизации 10,37 ºС. Температура кипения безводной серной кислоты при давлении 1,01·10 5 Па (760 мм рт.ст.) составляет 298,2 ºС. Плотность при 20 ºС составляет 1830,5 кг/м 3 .
С водой и сернистым ангидридом серная кислота смешивается в любых пропорциях.
В процессе производства серной кислоты для окисления сернистого ангидрида в серный применяются ванадиевый катализатор. Он представляет собой пористое вещество, на которое нанесено активное комплексное соединение, содержащее пятиокись ванадия V 2 O 5 .
В данном случае применяется катализатор марки VK-WSA фирмы "Хальдор Топсе".
Температура зажигания катализатора 400-430 ºС. При температуре выше 620 ºС активность катализатора быстро снижается, т.к. при этом распадается активный комплекс, содержащий пятиокись ванадия (V 2 O 5), а также разрушается структура носителя, что приводит к разрушению катализатора и образованию пыли.
Срок службы катализатора не менее 4 лет.
8. Термодинамический анализ
Расчет теплового эффекта реакции окисления SO 2 в SO 3 :
2SO 2 + O 2 = 2 SO 3
Q=-ΔН=196,6 кДж
Реакция экзотермическая – протекает с выделением тепла.
ΔG=ΔH-TΔS=-196,6-298*17,66=-5459,28
SO 3 :
SO 3 + H 2 O = H 2 SO 4
Q=-ΔН=174,26 кДж
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Таблица 1
Вывод: реакция окисления SO 2 наиболее полно протекает при невысоких температурах. Из этого следует, реакцию окисления SO 2 целесообразно проводить при невысоких температурах. Повышение давления, по принципу Ле-Шателье, влияет положительно.
9. Кинетика процесса окисления диоксида серы
Константа скорости реакции: определяется из уравнения Аррениуса.
К=К 0 *е (-Еа/RT) =9,3 *10 5 *е (-79000/430*8,31) =0,13
Еа- энергия активации (79000Дж/моль)
R- газовая постоянная (8,31)
Е- температура
К 0 – предэкспоненциальный множитель (9,3*10 5 сек)
Расчет равновесной степени превращения
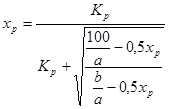
Таблица 3
Значения равновесной степени превращения при разных температурах
Исходя из полученных данных таблиц 3 и 4, можно сделать следующий вывод: с точки зрения равновесной степени превращения, процесс окисления диоксида серы нужно вести при низком содержании SO 2 в газовой смеси и при низких температурах.
Расчет времени контактирования газовой смеси в контактном аппарате
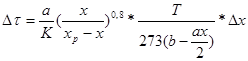
Таблица 5
Время контактирования газа на первом слое катализатора
τ = ∑Δτ =3,188 сек
Общее время контактирования на первом слое котализатораτ =3,188 сек.
Таблица 5
Время контактирования газа на втором слое катализатора
τ = ∑Δτ =6,38 сек
Расчет увеличения температуры
Т к = Тн + λΔх=787,26 К
Т н, Т к –начальная и конечная температуры, К
λ –коэффициент повышения температуры газа при изменении степени превращения на 1 % в адиабатических условиях
Δх – повышение степени превращения
10. Конденсация серной кислоты
Конденсация парой серной кислоты. В некоторых случаях, газ, используемый для получения серной кислоты, не содержит вредных примесей (мышьяка, фтора). Тогда экономически целесообразно не подвергать такой газ промывке в специальной аппаратуре, а передавать сразу на контактирование. Обычно его не подвергают также осушке, поэтому такой процесс называют мокрым катализом (например, получение серной кислоты из сероводорода). Газ, поступающий на стадию получения серной кислоты, содержит SO 3 и Н 2 0, и образование серной кислоты происходит не в результате абсорбции серного ангидрида растворами кислоты, а вследствие образования паров H2SO4 и конденсации их в башне с насадкой или другой аппаратуре, предназначенной для этого процесса.
Процесс конденсации более интенсивен (идет с большой скоростью), чем процесс абсорбции. Кроме того, конденсация протекает при высокой температуре, что облегчает отвод и использование тепла.
При медленном охлаждении газа, содержащего SO3 и Н 2 О, можно провести процесс конденсации паров серной кислоты без образования тумана. Однако скорость процесса при этом мала и часто экономически выгоднее вести охлаждение с большей скоростью, допуская образование некоторого количества тумана, а затем выделить этот туман из газовой смеси. Чтобы туман легче осаждался в фильтрах, процесс ведут при таких условиях, в которых образуются крупные капли. Этому соответствует невысокое значение возникающего пересыщения и более высокая температура орошающей кислоты, чем при обычном процессе абсорбции ("горячая" абсорбция).
Конденсация кислоты идет внутри стеклянных трубок, в которые поступает технологический газ, содержащий пары кислоты. Внутри стеклянных трубок расположены спирали, служащие в качестве центров для осаждения серной кислоты. На конце каждой трубки установлен патронный фильтр (каплеотбойник), предназначенный для улавливания тумана серной кислоты. Внешняя поверхность труб (межтрубное пространство) охлаждается атмосферным воздухом. Очищенный газ с остаточной концентрацией серной кислоты менее 20 ррм и температурой не более 120 градусов цельсия сбрасывается в дымовую трубу.
Около 35 % (масс.) серной кислоты конденсируется в объеме, при этом пары превращаются в капли жидкости, переходят в туман и уносятся потоком газа.
Давление пара в котле-утилизаторе поддерживается достаточно высоким, чтобы температура теплообменных поверхностей. котла была выше точки росы серной кислоты (275 °С).
Несконденсированный газ из башни-конденсатора по футерованному газоходу через гидравлический затвор поступает в мокрые электрофильтры. Последние предназначены для улавливания изгазов тумана серной кислоты концентрацией 93- 94 % (масс.). Гидравлический затвор может также служить брызгоуловителем. Очищенный газ выводится в атмосферу. Для первоначального прогрева катализатора в контактном аппарате используют пусковой подогреватель, в котором воздух нагревается за счет сжигания топливного газа.
Использование башни-конденсатора в производстве серной кислоты позволяет снизить количество стадий: в место 4 стадий процесс протекает в 3.
1 стадия - это сжигание сероводорода в котлах-утилизаторах;
2 стадия – это окисление диоксида серы в контактном аппарате
3 стадия – это конденсация паров серной кислоты в конденсаторе.
Данный аппарат позволяет избежать процесса абсорбции, что, в свою очередь, снижает количество аппаратов
11. Термодинамический анализ процесса конденсации
Расчет теплового эффекта реакции конденсации SO 3 :
SO 3 + H 2 O = H 2 SO 4
Q=-ΔН=174,26 кДж
Реакция экзотермическая- протекает с выделением тепла.
ΔG=ΔH-TΔS=-174,26-298*-288,07=-86019,12
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Н 2 О г = Н 2 О ж
Таблица 3
Значения термодинамических величин
При стандартных условиях реакция конденсации воды термодинамически возможна.
Реакция конденсации серной кислоты термодинамически возможна.
Расчет константы равновесия
D G =- R * T * lnKp
lgKp =- D G /2,3*8,31*Т
Kp =10 - D G /19,113*Т
Таблица 5
Значения констант равновесия в зависимости от температуры
| Т, 0 С | Т,К | DG | Kp |
| 100 | 373 | -84989,9 | 5,8*10 -4 |
| 200 | 473 | -61056,9 | 0,528 |
| 300 | 573 | -49090,4 | 45,43 |
| 400 | 673 | -37123,9 | 1,043*10 3 |
Из таблицы 5 видно, что с увеличением температуры реакции конденсации константа равновесия Кр падает.
Поэтому процесс конденсации целесообразно вести при повышенных температурах.
12. Описание технологической схемы процесса
Сырье на установку поступает двумя потоками:
Сероводородный газ установок Л-24-6, Л-24-7, Л-24-9, ГФУ под давлением от 0,35 до 0,6 кг/см 2 ;
Кислый газ с блока регенерации амина установки РАиОКС (тит.520) под давлением 0,6 кг/см 2 .
На входе установки потоки объединяются и направляются в сепаратор для выделения из него жидкой фазы. На трубопроводе сероводородного газа перед сепаратором установлен смеситель для впрыска деминерализованной воды для абсорбции аммиака и МЭА. Расход деминерализованной воды контролируется ротаметром FI-211.
Жидкая фаза из сепаратора по уровню поз.LISA-320 насосом Р-207А,С откачивается на блок сероочистки ГФУ или установку регенерации амина и отпарки кислых стоков.
Давление сероводорода на установку регулируется регулятором давления поз.PIC-165, клапан которого установлен на трубопроводе сброса H 2 S на факел.
Расход сероводорода на установку регистрируется прибором поз.FIQ-210, температура - прибором поз.TI-039.
Уровень в сепараторе оборудован сигнализацией по низкому и высокому уровню поз.LISA-320.
Из сепаратора сероводород поступает на сжигание в котлы-утилизаторы КУ-А,В,С через регуляторы расхода поз.FIC-404 (КУ-А), FIC-405 (КУ-В), FIC-406 (КУ-С) с клапанами-отсекателями USY-401 (КУ-А), USY-402 (КУ-В), USY-403 (КУ-С).
Давление сероводорода к котлам-утилизаторам регулируется приборами поз.PISA-401 (КУ-А), поз.PIСA-402 (КУ-В), поз.PIСA-403 (КУ-С) с сигнализацией и блокировкой по минимальному давлению в линии сероводорода на входе в котел-утилизатор.
Сжигание сероводорода в топке котлов-утилизаторов КУ-А,В,С до двуокиси серы (SO 2) происходит в токе воздуха, подаваемого от воздуходувки К-131.
Розжиг, разогрев и вывод на режим котлов-утилизаторов производится на топливном газе.
Общий расход топливного газа на установку регистрируется прибором поз.FIQ-632, давление топливного газа – прибором поз.PI-622, температура - поз.TI-603.
Топливный газ из заводской сети через электрозадвижку МО-019 поступает в сепаратор топливного газа, где происходит отделение газа от конденсата.
Уровень конденсата в сепараторе В-211 регистрируется прибором поз.LISA-999 с сигнализацией по низкому и высокому уровням поз.LISA-999 и блокировкой по минимальному уровню.
Конденсат из В-211 насосом Р-211А,В автоматически по максимальному уровню поз.LISA-999 (по минимальному насос останавливается) откачивается в линию газового конденсата с факельного хозяйства на АТ-6.
После сепаратора топливный газ подогревается в паровом подогревателе и подается к котлам-утилизаторам КУ-А,В,С.
Давление в линии топливного газа регулируется прибором поз.PICА-176, клапан которого установлен на линии топливного газа после.
Расход топливного газа к каждому котлу–утилизатору регулируется приборами поз.FIC-414 (КУ-А), FIC-420 (КУ-В), FIC-421 (КУ-С), клапаны которых установлены на соответствующих линиях топливного газа к котлам-утилизаторам.
На входе топливного газа в каждый котел-утилизатор смонтированы клапаны-отсекатели USY-416 (КУ-А), USY-417 (КУ-В), USY-418 (КУ-С), входящие в систему блокировок котла-утилизатора.
Предусмотрена блокировка по минимальному давлению топливного газа на подаче газа к форсункам котла-утилизатора – поз.PSA-416 (КУ-А), PSA-417 (КУ-В), PSA-418 (КУ-С).
Схемой предусмотрена подача азота в линию топливного газа для продувки системы перед розжигом котла и при подготовке его к ремонту.
Котел-утилизатор КУ-А,В,С состоит из циклонной топки, где происходит сжигание H 2 S, камеры охлаждения, системы выработки пара за счет утилизации тепла сгорания газов, в которую входят: двухбарабанный (верхний и нижний) котел, конвективный пучок и пароперегреватель.
Циклонная топка состоит из двойной металлической обшивки, образованной двумя концентрично расположенными цилиндрами из листовой стали. В полости между обшивками циркулирует горячий воздух, который поступает из межобшивочного пространства котла.
Подвод горячей смеси из сероводорода и воздуха осуществляется тангенциально через сопловое устройство у переднего торца циклона. Сопловое устройство представляет собой воздушный канал, проходящий через обмуровку котла под углом 40 º к горизонтальной оси.
Сероводород поступает в воздушный канал через отверстия в верхней стенке канала с давлением, большим, чем давление воздуха, и смешивается с ним.
Воспламенение смеси происходит на срезе канала, горение - внутри циклона при вращательном движении газового потока.
Для устранения неполного сжигания сероводорода в район пережима циклонной топки подается небольшое количество вторичного воздуха.
Розжиг сероводорода осуществляется с помощью топливного газа, поступающего в топку через запальное устройство.
Камера охлаждения образована левым и правым боковыми экранами и задней стенкой. В ней смонтировано три взрывных предохранительных клапана мембранного типа.
Пароперегреватель змеевикового типа расположен за конвективным пучком.
Верхний барабан с внутрибарабанным устройством предназначен для разделения пароводяной смеси на насыщенный пар и котловую воду, питания водой нижнего барабана и отвода насыщенного пара.
Нижний барабан предназначен для питания водой всех подъемных труб котла.
Обшивка котла двойная. Между внутренними и наружными листами обшивки проходит воздух, поступающий для горения. Давление воздуха между листами обшивки при всех режимах котла выше давления газа в котле, чем обеспечивается газовая плотность котла.
Обмуровка фронтальной стенки, потолка блока котла и обмуровка циклонной топки выполнена из огнеупорного бетона.
Расход воздуха в топку котла утилизатора КУ-А,В,С регулируется приборами поз.FIC-422 соответственно, клапаны которых установлены на подаче воздуха в котел-утилизатор. Регулирование расхода воздуха входит в каскадную схему управления сжигания сероводорода и поддерживает соотношение воздух-сероводород в интервале (10-12):1.
Давление воздуха на входе в котел-утилизатор КУ-А,В,С регистрируется прибором поз.PISА-420, PISА-421, PISА-422 соответственно. Предусмотрена сигнализация и блокировка по минимальному давлению на входе в каждый котел-утилизатор.
Предусмотрена блокировка "контроль наличия пламени" поз.BSA-401 (КУ-А), поз.BSA-402 (КУ-В), поз.BSA-403 (КУ-С), при срабатывании которой происходит останов котла-утилизатора.
Розжиг котла-утилизатора КУ-А,В,С на топливном газе и разогрев до перехода на сжигание сероводорода производится с выводом дымовых газов в атмосферу через свечу на выходе технологического газа из котла до шибера МО-22 (КУ-А), МО-23 (КУ-В), МО-24 (КУ-С).
Температура технологического газа на выходе КУ-А,В,С регулируется прибором поз.TICSA-407,408,409 посредством изменения расхода воздуха на сжигание сероводорода, выдерживая заданное соотношение воздух/газ. Если не выдерживается соотношение воздух/газ и температура выходит за пределы заданного диапазона температур, то происходит снижение (при увеличении температуры) и увеличение (при уменьшении температуры) расхода сероводорода в котел-утилизатор.
Ввод питательной воды, поступающей от насосов Р-201А,В,С, осуществляется в верхний барабан котла при помощи распределительной трубы на погруженный дырчатый лист.
Уровень питательной воды в верхний барабан котла-утилизатора регулируется приборами поз.LICА-304 (КУ-А), LICА-308 (КУ-В), LICА-312 (КУ-С), клапаны-регуляторы которых установлены на линии питательной воды в котел-утилизатор.
Расход питательной воды в котлы-утилизаторы КУ-А,В,С регистрируется приборами поз.FI-214,215,216, установленными на линии подачи питательной воды в котлы-утилизаторы соответственно.
Давление питательной воды на входе в котлы-утилизаторы регистрируется приборами поз.PI-115,116,117; температура - приборами поз.TI-016,019,026, установленными на входе питательной воды в котел.
Давление в барабане котла-утилизатора регистрируется прибором поз.PIА-155 (КУ-А), PIА-157 (КУ-В), PIА-159 (КУ-C) с сигнализацией по низкому и высокому давлению.
Уровень воды в верхнем барабане котла оборудован сигнализацией по низкому и высокому значению; блокировкой по минимальному и максимальному уровню воды поз.LSA-306, LSA-307 (КУ-А); LSA-310, LSA-311 (КУ-В); LSA-314, LSA-315 (КУ-С).
Вода из верхнего барабана котла опускается в нижний по пяти необогреваемым трубам (четыре из чистого и одна из солевого отсеков), на выходе которых установлены решетки для предотвращения захвата пара в опускные трубы. Затем котловая вода из нижнего барабана поступает в испарительные трубки радиантного экрана и конвекционного пучка. Пароводяная смесь из испарительных трубок поступает к отбойным щиткам верхнего барабана, которые обеспечивают отделение пара от капель воды. Насыщенный пар из верхней части барабана, пройдя сепарационное устройство, поступает в пароперегреватель, где нагревается до температуры 354 ºС. Пар из пароперегревателя поступает в редуцирующее устройство РОУ-40/15 для снижения давления с 34,0-38,5 кгс/см 2 до 15 кгс/см 2 .
Давление в паровой системе котлов-утилизаторов КУ-А,В,С регулируется прибором поз.PICА-160, клапан-регулятор которого установлен на линии вывода пара в РОУ-40/15.
Вода непрерывной продувки из солевых отсеков верхнего барабана котла поступает в емкости продувок.
Вода периодической продувки при дренировании котлов также поступает в барбатер-расширитель периодических продувок.
Из емкостей вода, охладившись в теплообменнике, где подогревает питательную воду деаэратора B-201, поступает в емкость. Из емкости насосом вода откачивается на установку ЭЛОУ.
Отбор проб котловой воды из линии непрерывной продувки осуществляется через холодильник отбора проб.
Технологический газ из котла-утилизатора КУ-А,В,С с температурой 530-650 ºС с объёмной долей SO 2 в пределах 7,5-8,5 % поступает в смеситель Х-103, где смешивается с воздухом и перегретым паром.
Для разбавления технологического газа используется воздух, выходящий после охлаждения конденсатора и нагнетаемый воздуходувкой. Разбавление технологического газа воздухом осуществляется до объёмной доли SO 2 3,5-4,5 %, что необходимо для снижения точки росы кислоты, содержащейся в нем, и для повышения степени окисления SO 2 в SO 3 .
Пар в технологический газ подается из системы пара среднего давления, предварительно подогретый в электроподогревателе Е-163 до температуры 250-300 ºС, и служит для поддержания влажности технологического газа с целью обеспечения достаточной конденсации серной кислоты в конденсаторе WSA E-109.
Общий расход технологического газа перед смешением с воздухом и паром регистрируется прибором поз.FI-702, температура – прибором поз.TIА-1103, объёмная доля SO 2 - автоматическим газоанализатором AIА-501.
Расход пара на смешение регулируется прибором поз.FIC-701, клапан-регулятор которого установлен на линии пара в электроподогревателе.
Температура пара после электроподогревателя регистрируется прибором поз.TICА-1101и регулируется системой управления ТЭНами электроподогревателя.
Расход воздуха на смешение регулируется прибором поз.FIC-703, клапан которого управляет лопатками приемного шибера воздуходувки.
Приборы расхода воздуха и пара связаны в каскадную схему регулирования температуры поз.TICА-1105 технологического газа на входе в контактный аппарат (конвертер) для поддержания температуры в пределах 385-430 ºС.
Технологический газ из смесителя с температурой 400-430 ºС направляется в контактный аппарат (конвертер), где происходит каталитическое превращение двуокиси серы (сернистый ангидрид) в серный ангидрид на двух слоях ванадиевого катализатора VK-WSA с межслойным охлаждением контактного газа.
Контактный аппарат представляет собой цилиндрический аппарат из нержавеющей стали, с двумя слоями катализатора высотой 820 мм и 1640 мм соответственно.
На первом слое катализатора примерно 90-93 % SO 2 превращается в SO 3 , при этом температура на выходе 1-го слоя повышается до 500–550 ºС. Для снятия тепла реакции газ с 1-го слоя охлаждается в рибойлере-газоохладителе Е-105 до температуры 380–410 ºС, где вырабатывается пар 62 кгс/см 2 , затем поступает в смеситель, а оттуда - на второй слой катализатора в. На втором слое происходит окончательное превращение SO 2 в SO 3 , при этом температура на выходе повышается до 410–430 ºС.
Температура газа на выходе из газоохладителя регулируется прибором поз.TICА-1107, клапан-регулятор которого управляет шиберами на байпасе газа трубного пучка газоохладителя.
Предусмотрена блокировка по максимальной температуре газа на входе в контактный аппарат – поз.TISA-1104; сигнализация высокой температуры газа на выходе первого слоя – поз.TIА-1106; сигнализация низкой и высокой температуры на выходе из газоохладителя – поз.TICА-1107,сигнализация низкой и высокой температуры на входе в E-108 – поз.TIА-1109.
Газ после контактного аппарата, предварительно охладившись в рибойлере-газоохладителе, направляется в конденсатор WSA для конденсации серной кислоты из газа.
Температура общего потока на входе в конденсаторе регистрируется прибором поз.TIА-1111 с сигнализацией по низкой и высокой температуре. Предусмотрена блокировка по максимальной температуре поз.TISA-1110 газа на входе в конденсатор.
Для снижения выбросов SO 3 в атмосферу вместе с отработанным газом на выходе конденсатора WSA предусмотрен блок управления кислыми парами. Снижение выбросов SO 3 достигается за счет подачи в газовый поток на вход в рибойлер паров силиконового масла, которое служит центрами конденсации серной кислоты в газе и тем самым усиливает конденсацию кислоты в конденсаторе WSA.
Поступление котловой воды в рибойлеры-газоохладители, обеспечивается за счет естественной циркуляции воды из барабана-паросборника
За счет утилизации тепла газового потока в рибойлерах, вырабатывается пар с давлением 62 кгс/см 2 , который из барабана-паросборника выводится к РОУ-40/15 через регулятор давления поз.PICSА-902.
Подача питательной воды осуществляется насосом Р-161А,В из деаэратора.
Уровень воды регулируется прибором поз.LICА-801 , клапан-регулятор которого установлен на линии питательной воды от насоса Р-161А,В, с сигнализацией по высокому и низкому уровню. Предусмотрена блокировка по минимальному уровню поз.LSA-802 в барабане-паросборнике В-162.
Для повышения надежности работы паросборника смонтирован дополнительный уровнемер поз.LIА-803.
Для поддержания химического состава котловой воды (уменьшения солесодержания) в системе предусмотрена автоматическая продувка из нижних точек по клапанам:
· HIC-753 тип "НЗ"– В-162;
· HV-791 – E-105;
· HV-792, HV-793, HV-794, HV-795 – Е-108.
Продувочная вода из В-162, Е-105, Е-108 поступает в емкость продувок В-206А, откуда совместно с продувочной водой котлов-утилизаторов КУ-А,В,С через теплообменник Е-202 сбрасывается в емкость В-203 и насосом Р-203А,В откачивается на установку ЭЛОУ.
Газ в Е-109 поступает двумя потоками.
Температура поверхности трубопроводов входа газа регистрируется приборами поз.TIА-1112, TIА-1113, установленными на входе каждого потока в Е-109, снижение показаний которых определяет уровень серной кислоты в Е-109 и возможную забивку труб аппарата.
Конденсатор WSA Е-109 представляет собой вертикальный аппарат, состоящий из 5-ти модулей, каждый из которых содержит 720 стеклянных трубок, длиной 6,8 м и диаметром 40 мм. Внутри стеклянных трубок расположены металлические спирали, служащие центрами для осаждения серной кислоты. На конце каждой трубки установлен патронный фильтр (каплеотбойник), предназначенный для улавливания тумана серной кислоты. Сборник кислоты расположен в нижней части конденсатора WSA. Корпус Е-109 футерован кислотостойким кирпичом и плиткой.
В конденсаторе Е-109 газ поднимается вверх внутри стеклянных труб, на внутренних поверхностях которых происходит конденсация серной кислоты за счет охлаждения воздухом, поступающим от воздуходувки К-130А,В между трубками.
Очищенный газ с остаточной массовой долей SO 3 менее 20 ррм и температурой не более 120 ºС сбрасывается в дымовую трубу.
Массовая доля SO 3 в очищенном газе измеряется прибором AIА-652 с сигнализацией высокого содержания SO 3 .
Температура очищенного газа регулируется прибором поз.TICА-1115, клапан-регулятор которого установлен на линии охлаждающего воздуха в подогреватель ХОВ Е-133 (сброс воздуха помимо Е-109).
Предусмотрена блокировка по максимальной температуре газа на выходе из Е-109 поз.TISA-1116.
Перепад между входом и выходом газа конденсатора Е-109 измеряется прибором поз.PDI-903.
Воздух на охлаждение конденсатора WSA Е-109 из атмосферы через воздушный фильтр А-133А,В забирается воздуходувкой К-130А,В и подается в межтрубное пространство Е-109 противотоком очищенному газу.
После конденсатора Е-109 охлаждающий воздух разделяется на потоки:
· один поток поступает на прием воздуходувки К-131, которая подает воздух на разбавление технологического газа после КУ-А,В,С;
· второй поток - воздуходувкой К-132 подается в топку котлов-утилизаторов КУ-А,В,С на сжигание сероводорода;
· часть потока выводится на прием воздуходувки К-130А,В для поддержания температуры воздуха на нагнетании воздуходувки в пределах 20–35 ºС;
· избыток воздуха сбрасывается на свечу через подогреватель ХОВ Е-133, утилизирующий тепло охлаждающего воздуха.
Температура воздуха на входе в Е-109 регулируется прибором поз.TIC-1117, шибер с пневмоприводом установлен на линии подачи части горячего воздуха на прием воздуходувки К-130А,В.
Температура воздуха после фильтра А-133А,В измеряется прибором поз.TIА-1123.
Предусмотрена сигнализация по низкому давлению воздуха на приеме воздуходувок К-130А,В – поз.PIA-911,912 соответственно.
Для предотвращения утечки технологического газа в охлаждающий воздух поддерживается перепад давления между системой охлаждающего воздуха и технологического газа в пределах 10–41 мм вод.ст. прибором поз.PDICSA-904, который управляет приемными шиберами воздуходувок К-130А,В. Предусмотрена сигнализация по низкому и блокировка по минимальному перепаду давления между системой охлаждающего воздуха и технологического газа конденсатора Е-109.
Сконденсированная серная кислота из конденсатора WSA Е-109 стекает вниз аппарата и направляется в емкость кислоты В-120.
Для снижения температуры кислоты, поступающей из Е-109, с 270 до 65 ºС в горячий поток кислоты добавляется холодный поток циркулирующей кислоты от насоса Р-121А,В.
Кислота из емкости В-120 насосом Р-121А,В прокачивается через пластинчатый холодильник кислоты Е-122, где охлаждается оборотной водой. и направляется:
· основная часть – в качестве рециркулята на смешение с горячей кислотой из Е-109,
· балансовое количество серной кислоты насосами Р-123А,В откачивается с установки.
Температура серной кислоты на приеме насосов Р-121А,В регистрируется прибором поз.TIА-1119 с сигнализацией по высокой температуре. Предусмотрена блокировка по максимальной температуре поз.TISA-1120 серной кислоты, поступающей на прием насосов Р-121А,В.
Уровень кислоты в емкости В-120 регулируется приборами поз.LICА-804, LISA-805, клапан установлен на линии откачки кислоты насосами Р-123А,В с установки на участок концентрирования серной кислоты тит.75-11 и на установку химводоподготовки тит.517 ПГПН. Существует два трубопровода откачки серной кислоты в парк 75-11, один из которых находится в резерве.
Предусмотрена сигнализация по низкому и высокому уровню – поз.LICА-804 и блокировка по минимальному и максимальному уровню – поз.LISA-805 емкости В-120.
Предусмотрена сигнализация по низкому и блокировка по минимальному давлению – поз.PICSА-906 в линии рециркуляции серной кислоты.
Массовая доля циркулирующей кислоты в пределах 93–98 % контролируется анализатором поз.AICА-653 и поддерживается автоматической подачей воды из емкости В-150 в линию циркуляции кислоты с помощью отсечного клапана USV 1207.
Уровень воды в емкости В-150 поддерживается прибором поз.LIA-803, клапан-регулятор которого установлен на линии воды в емкость В-150. Предусмотрена сигнализация по низкому и высокому уровням поз.LIА-803 в емкости В-150.
Расход серной кислоты с установки регистрируется прибором поз.FIQ-635.
Давление в линии откачки серной кислоты регистрируется прибором поз.PISA-907. В случае понижения давления в линии менее 0,2 кгс/см 2 по прибору поз.PICSА-906 включается резервный насос Р-123А,В. В ПбиС написано, что останавливается блок ВСА.
Для снижения содержания окислов азота (N 2 O 3) в товарной серной кислоте (менее 0,5 ppm) предусмотрена подача 64 %-ного водного раствора гидразин-гидрата дозировочным насосом Р-124 из емкости В-160 в трубопровод подачи серной кислоты на участок концентрирования тит.75-11. Готовый 64 %-ный водный раствор гидразин-гидрата поступает на установку в таре объемом 200 литров, из которой насосом с пневмоприводом закачивается в емкость В-160.
Для сбора аварийных разливов кислоты на установке предусмотрена заглубленная железобетонная емкость В-209, в которой происходит нейтрализация серной кислоты 15 %-ным раствором NaOH до значения рН в интервале 7,0–8,0 по анализатору AA-505.
Щелочной раствор во время нейтрализации в В-209 подается самотеком из емкости щелочи В-208, в которую периодически закачивается щелочь из реагентного хозяйства.
Перед подачей щелочи в Е-209 включается насос Р-209 на циркуляцию по емкости, и серная кислота нейтрализуется медленной подачей щелочи в емкость В-209.
Предусмотрена нейтрализация серной кислоты в В-209 кальцинированной содой. Согласно показаниям анализатора и при проверке по лакмусовой бумажке рН=7 нейтрализованный раствор насосом Р-209 откачивается в ПЛК по согласованию с УВКиОСВ.
13. Расчет материального баланса
2H 2 S + 3O 2 = 2SO 2 + 2 H 2 O
Производительность по газу 1749,8 м 3 /ч степень превращения H 2 S = 99.9
| Приход | Расход | |||||||||||
| Mr | кг | % масс | м3 | % об | кмоль | Mr | кг | % масс | м3 | % об | кмоль | |
| 58,00 | 45,31 | 0,23 | 17,50 | 0,12 | 0,78 | SO2 | 64,00 | 4944,48 | 25,64 | 1730,57 | 12,53 | 77,26 |
| 34,00 | 2629,39 | 13,63 | 1732,30 | 11,82 | 77,33 | H2O | 18,00 | 1460,94 | 7,57 | 1818,06 | 13,16 | 81,16 |
| 32,00 | 3870,85 | 20,07 | 2709,59 | 18,49 | 120,96 | N2 | 28,00 | 12741,53 | 66,06 | 10193,23 | 73,79 | 455,05 |
| 28,00 | 12741,53 | 66,06 | 10193,23 | 69,57 | 455,05 | H2S | 34,00 | 2,63 | 0,01 | 1,73 | 0,01 | 0,08 |
| - | 19287,07 | 100,00 | 14652,62 | 100,00 | 654,13 | CO2 | 44,00 | 137,48 | 0,71 | 69,99 | 0,51 | 3,12 |
| ∑ | - | 19287,07 | 100,00 | 13813,58 | 100,00 | 616,68 | ||||||
SО 2 + 0,5О 2 <=> SО 3
Степень превращения SО 2 = 98,5
| Приход | Расход | |||||||||||
| Mr | кг | % масс | м3 | % об | кмоль | Mr | кг | % масс | м3 | % об | кмоль | |
| 64,00 | 4944,48 | 46,03 | 1730,57 | 27,70 | 77,26 | SO3 | 80,00 | 6087,90 | 56,67 | 1704,61 | 31,60 | 76,10 |
| 32,00 | 1217,58 | 11,33 | 852,31 | 13,64 | 38,05 | SO2 | 64,00 | 74,17 | 0,69 | 25,96 | 0,48 | 1,16 |
| 28,00 | 4580,42 | 42,64 | 3664,33 | 58,66 | 163,59 | N2 | 28,00 | 4580,42 | 42,64 | 3664,33 | 67,92 | 163,59 |
| - | 10742,48 | 100,00 | 6247,21 | 100,00 | 278,89 | ∑ | - | 10742,48 | 100,00 | 5394,90 | 100,00 | 240,84 |
SO 3 + H 2 O= H 2 SO 4
Степень превращения SO 3 = 99,5%
| Приход | Расход | ||||||||||||
| Mr | кг | % масс | м3 | % об | кмоль | Mr | кг | % масс | м3 | % об | кмоль | ||
| SO3 | 80,00 | 6087,90 | 80,90 | 1704,61 | 49,75 | 76,10 | H2SO4 | 98,00 | 7420,39 | 98,61 | 1696,09 | 98,06 | 75,72 |
| H2O | 18,00 | 1362,93 | 18,11 | 1696,09 | 49,50 | 75,72 | SO3 | 90,00 | 30,44 | 0,40 | 7,58 | 0,44 | 0,34 |
| SO2 | 64,00 | 74,17 | 0,99 | 25,96 | 0,76 | 1,16 | SO2 | 64,00 | 74,17 | 0,99 | 25,96 | 1,50 | 1,16 |
| ∑ | 7524,99 | 100,00 | 3426,66 | 100,00 | 152,98 | ∑ | 7524,99 | 100,00 | 1729,62 | 100,00 | 77,22 | ||
14. Расчет теплового баланса
| Стандартная энтальпия образования ΔH (298 К, кДж/моль) | Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K) | Удельная теплоемкость C (кДж/кг К) | |
| SO2 | -296,90 | 39,90 | 0,62 |
| O2 | 0,00 | 29,35 | 0,92 |
| N2 | 0,00 | 29,10 | 1,04 |
| SO3 | -439,00 | 180,00 | 2,25 |
| H2O | -241,82 | 33,58 | 1,87 |
| H2SO4 | -814,20 | 138,90 | 1,42 |
| C4H10 | -124,70 | 97,78 | 1,69 |
| CO2 | -393,51 | 37,11 |
Тепловой баланс реакции окисления диоксида серы
SO 2 +1/2 O 2 = SO 3
Тепловой баланс реакции конденсации серной кислоты
SO 3 + H 2 O = H 2 SO 4
Из расчетов теплового баланса реакций окисления диоксида серы и конденсации серной кислоты видно, что в ходе этих реакций выделяется значительное количество тепла, которое необходимо отводить, что и делается в реальном технологическом процессе, для увеличения степени превращения этих реакций, а тепло утилизируют в различных целях как процесса, так и предприятия.
15. Расчет контактного аппарата
Расчет времени контактирования (приведен в кинетике процесса окисления диоксида серы)
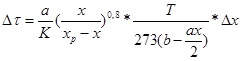
τ 1 = ∑Δτ =3,188 сек
τ 2 = ∑Δτ =6,38 сек
Суммарное время контактирования газа в контактном аппарате составляет
τ =3,188 + 6,38 = 9,568

![]() м 2
м 2
Расчет диаметра контактного аппарата
![]()
Диаметр контактного аппарата составляет 8 м
16. Меры безопасности при эксплуатации производственного объекта
Требования безопасности при пуске и остановке технологических систем и отдельных видов оборудования, выводе их в резерв, нахождении в резерве и при выводе из резерва в работу
Основным требованием безопасности при пуске и остановке технологического оборудования является строгое соблюдение процедуры пуска и остановки установки, изложенной в разделе 6 настоящего регламента.
Пуск в работу или вывод в резерв технологических систем производится по письменному распоряжению главного инженера ПГПН, в котором указывается лицо, ответственное за безопасное проведение работ и порядок организации пусковых работ или работ по выводу технологической системы в резерв.
Пуск в работу или вывод в резерв единичного оборудования производится по распоряжению начальника установки.
Оборудование считается резервным, когда оно находится в исправном состоянии, полностью укомплектовано контрольно-измерительными приборами, средствами сигнализации и ПАЗ, испытано в рабочих условиях, имеется заключение механика установки или цеха о его готовности к эксплуатации.
В зимнее время все резервное оборудование должно находиться на прогреве.
Находящееся в резерве оборудование должно подвергаться ежедневному визуальному осмотру, а динамическое оборудование – осмотру и обкатке с установленной периодичностью, но не реже 1 раза в месяц. У центробежных насосов необходимо ежесменно проворачивать вал от руки.
Перед пуском в работу технологическая система должна быть продута азотом с контролем остаточного содержания кислорода не более 0,5 %об. Вывод технологической системы на нормальный технологический режим производится согласно раздела 6 настоящего регламента.
Перед каждым пуском резервных насосов проверить их исправность и положение запорной арматуры на всасе и выкиде насоса.
Ремонт горячего насоса, выделенного в резерв, следует начинать только после того, как температура корпуса его не будет превышать 45 ºС.
Контактный аппарат R-104 отдувается от паров серной кислоты горячим воздухом через конденсатор WSA Е-109 и далее в дымовую трубу. Для проведения работ внутри R-104 во время остановки катализатор и контактный аппарат охлаждается воздухом от воздуходувки К-132 по схеме технологического газа. Если катализатор не выгружается из аппарата, в R-104 поддерживается избыточное давление воздуха, подаваемого в аппарат по шланговой перемычке, для исключения контакта катализатора с атмосферным воздухом.
Требования к обеспечению взрывобезопасности технологического процесса: принятые границы технологических блоков, значения энергетических показателей и категории взрывоопасности блоков, границы возможных разрушений при взрывах, предусмотренные меры безопасности и противоаварийной защиты
В целях повышения безопасности и ограничения массы продуктов, которые могут истечь в окружающую среду в результате аварий, на установке предусмотрены: быстродействующая отсекающая арматура на линиях перед насосами, стопроцентный резерв по насосам, системы самозапуска насосов и АВР; обвязка теплообменных аппаратов имеет байпасы и отключающую запорную арматуру.
Установка оснащена распределенной системой управления технологическим процессом (РСУ) и системой противоаварийной защиты (ПАЗ). Световая и звуковая сигнализация срабатывает при предельно допустимых значениях технологических параметров.
На установке выделен один взрывоопасный технологический блок – блок сепарации.
Оценка взрывоопасности технологического блока произведена в соответствии с требованиями Общих правил взрывоопасности химических, нефтехимических и нефтеперерабатывающих производств" (ПБ 09-540-03). При этом в технологические блоки включены аппараты, необходимые для осуществления основного технологического процесса. В состав блоков включены трубопроводы между аппаратами блока, а также арматура и приборы КИПиА.
Меры безопасности, принимаемые при ведении технологического процесса с выполнением регламентных операций, должны отвечать требованиям нормативно-технической документации, определяющей порядок и условия безопасного ведения производственного процесса, действий персонала в аварийных ситуациях и осуществления ремонтных работ. Перечень указанной технической документации должен быть утвержден главным инженером ПГПН.
В целях безопасности ведения процесса выполнены следующие мероприятия:
Вся аппаратура и трубопроводы вне помещения, имеющие температуру стенки свыше 60 ºС, а в помещениях свыше 45 ºС, теплоизолируется;
Все оборудование и трубопроводы для защиты от статического электричества заземляются. Установка имеет молниезащиту;
Ограждены все движущиеся части механизмов;
Резервуар В-120 снабжен сигнализаторами верхнего и нижнего уровня.
Обязательный объем периодического контроля состояния и параметров работы установки путем обхода персоналом, а также ее обслуживания включает в себя:
· контроль температур и давлений в аппаратах по приборам, установленным на местах;
· проверку центробежных насосов на отсутствие вибрации и постороннего шума (на исправность);
· проверку герметичности фланцевых соединений, сальниковых уплотнений запорной арматуры и торцевых уплотнений центробежных насосов;
· визуальный контроль за отсутствием вибрации технологических трубопроводов, особенно на выкиде насосов;
· проверку наличия и исправности штатных контрольно-измерительных приборов;
· визуальный контроль за наличием и исправным состоянием ограждений движущихся частей механизмов, площадок обслуживания;
· визуальный контроль за исправным состоянием вентиляционных систем;
· визуальный контроль за исправным состоянием грузоподъемного оборудования;
· проверку пробоотборных устройств на отсутствие утечки продуктов.
В зимний период дополнительно необходимо выполнять следующие операции:
· контроль за функционированием обогрева паром низкого давления аппаратов, технологических трубопроводов, приборов КИПиА;
· контроль за функционированием обогрева теплофикационной водой приборов КИПиА, калориферов приточной вентиляции и технологических трубопроводов;
· контроль за системами охлаждения центробежных насосов, обеспечивая постоянный проток воды;
· контроль на проходимость дренажей и дренажных линий;
· контроль за работой конденсатоотводчиков.
Запрещается снятие блокировок в системах автоматического управления процессом.
При возникновении аварийных ситуаций, вызванных отклонениями параметров работы установки от требований норм технологического режима, изложенных в разделе 4 настоящего регламента, действовать согласно "Плану локализации аварийных ситуаций" (ПЛАС).
Все виды ремонтных работ должны выполняться в соответствии с годовыми и месячными "Графиками проведения планово-предупредительного ремонта". Ремонтные работы должны осуществляться в соответствии с требованиями инструкций, утвержденных Главным инженером Общества:
Инструкция о порядке безопасного проведения ремонтных работ в ООО "ЛУКОЙЛ-ПНОС" (ИБ-025-003-2005);
Инструкция о порядке безопасного проведения огневых работ на объектах ООО "ЛУКОЙЛ-ПНОС" (ПБ-0001-1-2005);
Инструкция о порядке безопасного проведения газоопасных работ на объектах ООО "ЛУКОЙЛ-ПНОС" (Б-025-002-2005);
Инструкция о порядке безопасного проведения земляных работ на территории ООО "ЛУКОЙЛ-ПНОС" (ИБ-255-004-2005).
Отбор проб сероводорода и дренирование сепараторов и емкостей проводить в противогазе стоя спиной к ветру с дублером в противогазе.
Меры безопасности при ведении технологического процесса, выполнении регламентных операций
Безопасная работа установки зависит от квалификации обслуживающего персонала, соблюдения правил техники безопасности, пожарной и газовой безопасности, правил технической эксплуатации оборудования и коммуникаций, соблюдения норм технологического регламента.
К работе допускаются лица достигшие, 18и летнего возраста, прошедшие инструктаж по промышленной безопасности и охране труда, теоретическое и практическое обучение безопасным приемам и методам работы и сдавшие экзамен на допуск к самостоятельной работе, не имеющих медицинских противопоказаний.
Всянеобходимая нормативно-техническая документация, определяющая порядок и условия безопасного ведения производственного процесса, действий персонала в аварийных ситуациях и осуществления ремонтных работ, согласно перечню, утвержденному главным инженером ПГПН, должна быть в наличии на установке, ее знание и соблюдение персоналом обязательно.
Работать можно только на исправном оборудовании. Постоянно следить за работой приборов контроля и автоматики, систем сигнализации и блокировок. Строго выдерживать все параметры технологического режима.
Во избежание загазованности в производственных помещениях создается избыточный подпор воздуха в операторной, насосной, трансформаторной подстанции, электрощитовых с кратностью воздухообмена 5.
Насосы оборудованы торцевыми уплотнениями.
Все аппараты, работающие под давлением, снабжены предохранительными клапанами. Сброс горючих газов от предохранительных клапанов осуществляется в факельную линию; задвижка на факельной линии при работе установки должна быть открыта.
Освещение установки выполнено в соответствии с действующими норматива ми, осветительная арматура принята взрывозащищенного исполнения.
Мероприятия по обеспечению пожарной безопасности при проведении технологического процесса
Пожарная безопасность установки достигается системой предотвращения образования горючей среды, предотвращением образования в горючей среде источников зажигания, максимальной автоматизацией технологического процесса, применением средств пожаротушения и пожарной сигнализации, применением основных строительных конструкций с регламентированными пределами огнестойкости и пределами распределения огня, соблюдением инструкций и правил пожарной безопасности при эксплуатации зданий, сооружений и оборудования.
Территория производственного объекта, а также производственные помещения и оборудование должны постоянно содержаться в чистоте и порядке.
Курение на установке запрещено . Курение допускается в специально отведенном месте (по согласованию с пожарной охраной), оборудованном урной для окурков и огнетушителем.
За герметичностью оборудования, особенно фланцевых соединений и сальников, со стороны обслуживающего персонала необходим строгий контроль. В случае обнаружения пропуска, необходимо немедленно подать водяной пар к месту пропуска и принять меры к отключению аварийного участка или аппарата из работы.
В зимних условиях отогревать замерзшую аппаратуру, трубопроводы, задвижки разрешается только паром или горячей водой. Использование открытого огня запрещается.
На случай возникновения пожара в производственных помещениях предусмотрена возможность безопасной эвакуации людей.
При пожаре или аварии на установке персонал, не участвующий в ликвидации пожара или аварийной ситуации, эвакуируется с территории объекта.
Расположение оборудования и зданий предусматривает соблюдение соответствующих противопожарных разрывов.
На установке предусмотрены следующие средства пожаротушения:
5 стационарных лафетных стволов, защищающих оборудование на наружной установке;
Противопожарная вода подается к лафетным стволам от сети противопожарного водопровода предприятия;
Для локального тушения очага возгорания в производственных помещениях и на наружной установке предусмотрены паровые стояки;
Установка обеспечена резиновыми шлангами для подачи пара или азота к местам возможного загорания;
На установке в установленных местах предусмотрены воздушно-пенные и порошковые огнетушители, ящики с песком, войлок, асбополотно;
Защита помещений автоматической пожарной сигнализацией;
Предусмотрены ручные извещатели пожарной сигнализации, расположенные снаружи здания и по периметру установки;
Размещение сооружений, оборудования, аппаратов, эвакуационные пути и выезды выполнены с учетом норм и правил пожарной безопасности и обеспечивают эвакуацию людей из зданий и помещений до наступления предельно допустимых значений опасных факторов пожара.
Безопасные методы обращения с пирофорными отложениями
Аппараты и трубопроводы после вывода оборудования из работы и их освобождения от продуктов следует пропарить водяным паром.
После освобождения аппарата от конденсата должен быть вскрыт нижний штуцер или люк и взята проба воздуха для анализа на содержание в нем опасных концентраций паров продукта (должно быть не более 20 % от нижнего концентрационного предела распространения пламени НКРП).
Во время чистки аппаратов необходимо смачивать отложения, находящиеся на стенках аппарата. При чистке аппаратов применяются искробезопасные инструменты. На выполнение этих работ оформляется наряд-допуск в установленном порядке.
Пирофорные отложения, извлеченные из оборудования, необходимо поддерживать во влажном состоянии до их уничтожения. Пирофорные отложения вывезти на хранение в шламонакопитель УВКиОСВ.
Способы обезвреживания продуктов производства при разливах и авариях
При разливе серной кислоты в насосной немедленно устроить обвалование из песка для предотвращения дальнейшего растекания продукта. Перед уборкой разлитого продукта и нейтрализовать его содой или известью.
Удаление серной кислоты при освобождении фильтров, ремонте кислотных насосов Р-121А,В, Р-123А,В или отборе проб происходит в заглубленную емкость и нейтрализуется 10 %-ным раствором щелочи.
При нейтрализации разлитой серной кислоты работы производить в спецодежде и пользоваться противогазом.
Безопасный метод удаления продуктов производства из технологических систем и отдельных видов оборудования
При остановке установки на ремонт сероводородный газ направляется на факел.
Контактный аппарат (конвертер) R-104 продувается первоначально дымовыми газами от паров серной кислоты через конденсатор WSA Е-109, затем горячим воздухом по нормальной схеме в дымовую трубу.
Серная кислота откачивается в товарный парк 75-11. Остатки кислоты сливаются в заглубленную емкость В-209 и нейтрализуется 10 %-ным раствором щелочи, либо засыпаются кальцинированной содой, (до рН=7), затем откачиваются в ПЛК, по согласованию с УВКиОСВ.
Основные потенциальные опасности применяемого оборудования и трубопроводов, их ответственных узлов и меры по предупреждению аварийной разгерметизации технологических систем
Основными потенциальными опасностями применяемого технологического оборудования и трубопроводов, их ответственных узлов на установке являются:
· перерабатываемый на установке сероводородсодержащий газ является взрывоопасным, пожароопасным и токсичным;
· сероводород в присутствии водяных паров является сильным коррозионным веществом, воздействующим на металл, следствием чего может быть разгерметизация технологического оборудования;
· наличие избыточного давления (до 15 кгс/см 2 – пар среднего давления) и высоких температур в аппаратах и трубопроводах создаёт угрозу их разрыва;
· при нарушении режимов работы оборудования или в случаях его механического или коррозионного износа возможна разгерметизация с возникновением взрывопожароопасных и токсичных концентраций газов, что может привести к взрывам и/или загораниям, а также отравлению персонала;
· поражение электрическим током в случае выхода из строя заземления токоведущих частей оборудования или пробоя электроизоляции;
· возможность падения обслуживающего персонала при обслуживании аппаратов и трубопроводов, расположенных на высоте более одного метра, в случае отсутствия ограждения или его неисправности;
· возможность получения термического ожога в случае контакта незащищенных частей тела с нагретыми поверхностями аппаратов и трубопроводов с нарушенной изоляцией;
· наличие вращающихся механизмов создает угрозу получения от них травм;
· возможность разгерметизации или разрушения аппаратов и трубопроводов под воздействием внешних силовых факторов.
Мерами по предупреждению аварийной разгерметизации технологических систем являются:
· термообработка основного технологического оборудования и сварных участков трубопроводов на средах, вызывающих коррозионное растрескивание;
· обеспечение соответствия оборудования трубопроводов, запорной арматуры, предохранительных устройств, систем защитной автоматики, сигнализации требованиям действующих НТД;
· оценка технического состояния аппаратов, оборудования, трубопроводов и других элементов установки;
· эксплуатация только исправного оборудования и своевременное выполнение планово-предупредительного ремонта;
· своевременное освидетельствование оборудования;
· обеспечение качественного ремонта и чистки аппаратов, трубопроводов;
· ведение технологического процесса без нарушения норм настоящего технологического регламента, исключающих выход параметров работы аппаратов и оборудования за критические значения.
17. Список используемой литература
1. Технологический регламент установки серной кислоты
2. Б.Т.Васильев, М.И.Отвагина; Технология серной кислоты. Москва: Химия 1985г. 386 стр.
3. А.М.Кутепов; Общая химическая технология. Москва: Высшая школа, 1990г. 520 стр.
4. Амелин А.Г. Производство серной кислоты. Москва 1983 г.