Гидроксид кремния 4. Оксид кремния (IV) и кремниевые кислоты
Оксид кремния SiO 2 - твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита.
При обычных температурах устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения:
Кремнезем всех модификаций в виде мономера не существует; он всегда полимерен и «построен» из тетраэдров , образующих очень прочную атомную решетку
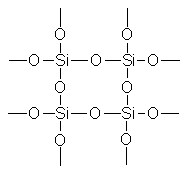
Каждый атом кремния в кристаллах (SiO 2) n тетраэдрически окружен четырьмя атомами кислорода, каждый из которых является мостиковым. Через общий атом кислорода тетраэдры под разными углами связываются друг с другом, образуя непрерывную трехмерную решетку; взаимное расположение тетраэдров в пространстве определяет ту или иную модификацию кремнезема.
В различных модификациях кремнезема прочность связей неодинакова. Это влияет на величину углов Si-О-Si и расстояний Si-О, например угол связи Si-О-Si в различных модификациях кремнезема изменяется от 120 до 180°. Переходы кварц-тридимит-кристобалит сопровождаются разрывом и преобразованием связей, что может происходить только при высоких температурах.
Кварц. Нередко встречается в природе в форме чрезвычайно хорошо образованных кристаллов, иногда значительной величины. Кристаллы образованы из тетраэдров, расположенных винтообразно вокруг центральной оси, в виде спирали. В одном и том же кристалле направление спирали может быть противоположным. Такие кристаллы являются оптическими изомерами. Они вращают плоскость поляризации света, причем могут быть как право-, так и левовращающими. Те и другие кристаллы отличаются как предмет от своего зеркального изображения.
Кварц используется в различных областях науки и техники, и его кристаллы часто выращиваются искусственно. Некоторые разновидности кварца носят особые названия. Прозрачные бесцветные кристаллы называют горным хрусталем. Встречаются и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист), темно-коричневый (дымчатый топаз), зеленый (хризопраз) и др. Мелкокристаллическая модификация кварца с примесями других веществ называется халцедоном. Разновидностями халцедона являются агат, яшма и др. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Тридимит встречается в вулканических породах, однако в очень небольших количествах. Известен тридимит и метеоритного происхождения.
Кристобалит в природе иногда встречается в виде мелких кристаллов, включенных в лаву, подобно тридимиту. Тридимит и кристобалит обладают более «рыхлой» структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца равна 2,32; 2,26 и 2,65 г/см 3 соответственно.
Расплав кремнезема при медленном охлаждении легко образует аморфное кварцевое стекло. Кремнезем в виде стекла встречается и в природе. Плотность аморфного стекла равна 2,20 г/см 3 - ниже, чем у всех кристаллических модификаций. Кварцевое стекло имеет незначительный температурный коэффициент расширения, поэтому из него готовят лабораторную посуду, устойчивую к резким изменениям температуры.
Все модификации кремнезема в воде практически нерастворимы (при температуре 25 °С растворимость кварца составляет 7, кристобалита - 12, тридимита - 16, кварцевого стекла - 83 мг/л). Поэтому при обычных условиях на них действуют лишь растворы щелочей и плавиковая кислота:
SiO 2 + 2КОН = К 2 SiO 3 + Н 2 О, (1)
SiO 2 + 4НF = SiF 4 + 2Н 2 О. (2)
Последняя реакция используется при «травлении» стекла.
Приставленый диоксид кремния реагирует с основными оксидами, щелочами (реакция (1)) и карбонатами с образованием силикатов:
SiO 2 + СаО = СaSiO 3 , (3)
SiO 2 + Na 2 СО 3 = Nа 2 SiO 3 + СО 2 . (4)
Реакции (3) и (4) лежат в основе промышленного получения различных стекол, а также цемента. Так, состав обычного стекла (например, оконного, для изготовления посуды) выражается формулой Na 2 О. СаО. 6SiO 2 . Такое стекло получают сплавлением смеси соды, песка и известняка. Процесс проводят при температуре ~1400 °С до полного удаления газов:
Na 2 СО 3 + СаСО 3 + 6SiO 2 = Nа 2 О. СаО. 6SiO 2 + 2СО 2 .
Для получения специальных сортов стекла - огнеупорного, «небьющегося» - при варке добавляют оксиды бария, свинца, бора. Для получения цветных стекол вносят также различные добавки, например добавка оксида кобальта Со 2 О 3 дает синий цвет, оксида хрома Сr 2 О 3 - зеленый, двуоксида марганца МnО 2 - розовый.
Оксид SiO 2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой хSiO 2∙ yН 2 O, где х и у - целые числа: 1) х = 1, у = 1: SiO 2 . Н 2 О, т.е. Н 2 SiO 3 - метакремниевая кислота; 1) х = 1, y = 2: SiO 2 . 2Н 2 О, т.е. ортокремниевая кислота; 1) x = 2, у = 1: 2SiO 2 . Н 2 О, т.е. Н 2 Si 2 O 5 – двуметакремниевая кислота.
Кислоты, молекулы которых содержат более одной молекулы SiO 2 , относятся к поликремниевым.
Самая простая из кремниевых кислот - Н 2 SiO 3 , которую часто называют просто кремниевой, а ее соли - силикатами. Из силикатов в воде растворимы только силикаты натрия и калия, остальные силикаты - тугоплавкие, нерастворимые в воде вещества.
Растворы силикатов мутнеют при стоянии на воздухе, так как находящийся в нем СО 2 вытесняет кремниевую кислоту из ее солей (Н 2 SiO 3 слабее угольной кислоты; константа диссоциации Н 2 SiO 3 по первой ступени равна К 1 = 2,2 . 10 -10).
Н 2 SiO 3 практически нерастворима в воде - это свойство используют как качественную реакцию для обнаружения силикат-ионов:
Na 2 SiO 3 + СО 2 + Н 2 О = Nа 2 СО 3 + Н 2 SiO 3 ↓.
Получают силикаты сплавлением SiO 2 со щелочами или карбонатами.
Концентрированные растворы силикатов натрия и калия называют жидким стеклом, они имеют сильнощелочную реакцию вследствии того, что сильно гидролизованы:
К 2 SiO 3 + Н 2 О 2КОН + Н 2 SiO 3 ↓.
Жидкое стекло используют, например, для изготовления клея, водонепроницаемых тканей.
Цемент очень широко используется в строительстве как вяжущий материал, который при смешивании с водой затвердевает. Обычно цемент получают в больших вращающихся печах, где производят обжиг и размол различных силикатов (при температуре -1000 °С).
Различают несколько типов цементов, однако условно можно выделить два типа цементов по принципу их «свертывания» - обычный цемент и портландский цемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция за счет углекислого газа воздуха:
СаО. SiO 2 + СО 2 + Н 2 О = СаСО 3 ↓ + Н 2 SiO 3 ↓.
При схватывании портландского цемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов:
Са 3 SiO 5 + Н 2 О = Са 2 SiO 4 + Са(ОН) 2 ,
Са 2 SiO 4 + 4Н 2 О = Са 2 SiO 4 . 4Н 2 O↓.
· Карбиды и силициды
· Соединения углерода и кремния с металлами - карбиды и силициды, помимо рассмотренных реакций получают также взаимодействием кремния с гидридами металлов, например:
· 2СаН 2 + Si = Са 2 Si + 2Н 2 .
· Все эти реакции протекают при высоких температурах. Среди карбидов выделяют так называемые «метаниды» и «ацетилениды». Первые рассматривают как производные метана, содержащие углерод в степени окисления -4 (Ве 2 С, Аl 4 С 3), вторые - как производные ацетилена со степенью окисления углерода -1 (Li 2 С 2 , Аg 2 С 2 , Сu 2 С 2 , СаС 2). Ацетилениды серебра и меди (I) могут быть легко получены при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I). Большинство метанидов и ацетиленидов активно реагируют с водой (тем более с кислотами), выделяя соответствующие углеводороды:
· СаС 2 + 2Н 2 О = Са(ОН) 2 + С 2 Н 2 ,
· Al 4 C 3 + 12H 2 O = 4Al(OH) 3 ↓ + 3CH 4 ,
· Аg 2 С 2 + 2НСl = 2АgСl↓ + С 2 Н 2 .
· В отличие от карбидов, с водой и кислотами взаимодействуют лишь силициды щелочных или щелочноземельных металлов, выделяя простейшее водородное соединение кремниямоносилан, которое чаще всего называют просто силан SiН 4:
· Са 2 Si + 4НСl = 2СаСl 2 + SiН 4 .
· Силан - бесцветный газ, имеющий запах плесени, самопроизвольно воспламеняющийся на воздухе, сгорая до SiO 2 и воды:
· SiН 4 + 2О 2 = SiO 2 + 2Н 2 О.
· Щелочи очень легко разлагают силан по уравнению:
· SiН 4 + 2КОН + Н 2 О = К 2 SiO 3 + 4Н 2 ,
· вода также гидролизует силан, но значительно медленнее:
· SiН 4 + 2Н 2 О = SiO 2 + 4Н 2 .
· При нагревании выше 400 °С без доступа воздуха силан распадается на кремний и водород (один из способов получения кремния):
· SiН 4 = Si + 2Н 2 .
· Кроме моносилана, известны также дисилан Si 2 Н 6 , трисилан Si 3 Н 8 , тетрасилан Si 4 Н 10 и т.д. В индивидуальном состоянии выделены соединения лишь до Si 6 Н 14 включительно. Все эти соединения относятся к гомологическому ряду силанов, которым отвечает общая формула Si n Н 2 n +2 . Подобно алканам, силаны бесцветны, первые члены гомологического ряда при обычных условиях газообразны, следующие - жидкости. Химическая активность силанов и углеводородов различна: в противоположность достаточно инертным алканам, силанывесьма реакционноспособны. Это объясняется меньшим по сравнению с углеродом сродством кремния к водороду и очень большим сродством кремния к кислороду. К тому же связиSi-Si менее прочны, чем связи С-С. В отличие от связи С-Н связь Si-Н имеет более ионный характер.
· Энергии связей Si-Э и С-Э.
· Малой прочностью связи Si-Si обусловлена ограниченность гомологического ряда силанов.
· Среди карбидов и силицидов особое место занимает карборунд SiC, который можно назвать как карбидом кремния, так и силицидом углерода. Карборунд имеет высокую температуру плавления, благодаря алмазоподобной структуре; его твердость близка к твердости алмаза. Химически SiC очень стоек.
· Понятие о коллоидных растворах
В природе и технике часто встречаются дисперсные системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества.
В дисперсных системах различают дисперсную фазу - мелкораздробленное вещество и дисперсионную среду - однородное вещество, в котором распределена дисперсная фаза. К дисперсным системам относятся обычные (истинные) растворы, коллоидные растворы, а также суспензии и эмульсии. Они отличаются друг от друга прежде всего размерами частиц, т. е. степенью дисперсности (раздробленности).
Системы с размером частиц менее 1 нм представляют собой истинные растворы, состоящие из молекул или ионов растворенного вещества. Их следует рассматривать как однофазную систему. Системы с размерами частиц больше 100 нм - это грубодисперсные системы - суспензии и эмульсии.
Суспензии - это дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой - жидкость, причем твердое вещество практически нерастворимо в жидкости.
Эмульсии - это дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающимися. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости.
Суспензии и эмульсии - двухфазные системы.
Коллоидные растворы - это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы иначе называют золями. Их получают дисперсионными и кондесационными методами. Диспергирование чаще всего производят при помощи особых «коллоидных мельниц». При конденсационном методе коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты. При протекании многих химических реакций происходитконденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
1 нм - нанометр (1 нм = 10 -9 м).
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении 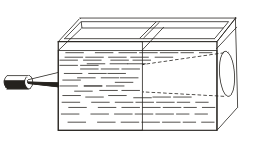 . Так можно распознать, является данный раствор коллоидным или истинным.
. Так можно распознать, является данный раствор коллоидным или истинным.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, - положительный заряд. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести - седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
Диоксид кремния (silica, Silicon dioxide, кремнезем) - вещество, состоящее из бесцветных кристаллов, обладающих высокой прочностью, твердостью и тугоплавкостью. Диоксид кремния устойчив к воздействию кислот и не взаимодействует с водой. При повышении температуры реакции вещество взаимодействует со щелочами, растворяется в плавиковой кислоте, является прекрасным диэлектриком.
В природе диоксид кремния распространен довольно широко: кристаллический оксид кремния представлен такими минералами как яшма, агат (мелкокристаллические соединения двуокиси кремния), горный хрусталь (крупные кристаллы вещества), кварц (свободная двуокись кремния), халцедон, аметист, морион, топаз (окрашенные кристаллы диоксида кремния).
В обычных условиях (при естественной температуре окружающей среды и давлении) существуют три кристаллических модификации диоксида кремния - тридимит, кварц и кристобалит. При повышении температуры диоксид кремния сначала превращается в коэсит, а затем - в стишовит (минерал, обнаруженный в 1962 году в метеоритном кратере). Согласно исследованиям, именно стишовит - производное вещество диоксида кремния - выстилает значительную часть мантии Земли.
Химическая формула вещества - SiO 2
Получение диоксида кремния
Диоксид кремния промышленным способом получается на кварцевых заводах, производящих чистый кварцевый концентрат, который затем используется в химической и электронной промышленности, в производстве оптики, наполнителей для резиновых и лакокрасочных изделий, изготовлении ювелирных украшений и т.д. Природный диоксид кремния, иначе называемый кремнеземом, широко применяется в строительстве (бетон, песок, звуко- и теплоизолирующие материалы).
Получение диоксида кремния синтетическим способом осуществляется с помощью воздействия кислот на силикат натрия, в некоторых случаях - на иные растворимые силикаты или методом коагуляции коллоидного кремнезема под воздействием ионов. Кроме того, диоксид кремния получают путем окисления кремния кислородом при температуре около 500 градусов Цельсия.
Применение диоксида кремния
Кремнийсодержащие материалы нашли широкое применение как в области высоких технологий, так и в повседневной жизни. Диоксид кремния используется в производстве стекла, керамики, изделий из бетона, абразивных материалов, а также в радиотехнике, ультразвуковых установках, зажигалках и т.д. В сочетании с рядом ингредиентов диоксид кремния применяется в изготовлении волоконно-оптических кабелей.
Непористый аморфный диоксид кремния используется также в пищевой промышленности в качестве добавки, зарегистрированной под номером Е551, препятствующей комкованию и слеживанию основного продукта. Диоксид  кремния пищевой используется в фармацевтической промышленности в качестве лекарственного препарата-энтеросорбента, в производстве зубных паст. Вещество встречается в составе чипсов, сухариков, кукурузных палочек, растворимого кофе и т.д.
кремния пищевой используется в фармацевтической промышленности в качестве лекарственного препарата-энтеросорбента, в производстве зубных паст. Вещество встречается в составе чипсов, сухариков, кукурузных палочек, растворимого кофе и т.д.
Вред диоксида кремния
Официально подтверждено, что вещество диоксида кремния проходит через желудочно-кишечный тракт неизменным, после чего полностью выводится из организма. Согласно 15-летним исследованиям французских специалистов употребление питьевой воды с высоким содержанием пищевого диоксида кремния снижает риски развития болезни Альцгеймера на 10%.
Таким образом, информация о вреде диоксида кремния, являющегося химически инертным веществом, ложна: пищевая добавка Е551, употребляемая внутрь пероральным путем, полностью безопасна для здоровья.
Оксид кремния (II) SiO. В природе он не встречается, но может быть получен по реакции:
SiO 2 + Si → 2 SiO.
Под обычным давлением возгонка монооксида кремния начинается около 1200 °С (когда сами исходные вещества ещё практически не испаряются). В парах SiO является индивидуальным соединением. Энергия диссоциации на элементы 789 кДж/моль. Перевод его в твёрдое состояние может быть осуществлён только быстрым охлаждением (“закалкой”) газовой фазы. В противном случае успевает пройти дисмутация по уравнению:
2 SiO = SiO 2 + Si.
Монооксид кремния медленно окисляется кислородом воздуха и легко растворяется в щелочах с образованием солей кремневой кислоты и выделением водорода. Он легко электризуется от трения, приобретая сильный отрицательный заряд.
Оксид кремния (IV) SiO 2 . Оксид кремния (IV) называют также кремнеземом. Это твердое тугоплавкое вещество (температура плавления 1700°С) , широко распространенное в природе в двух видах:1) кристаллический кремнезем - в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности; 2) аморфный кремнезем - в виде минерала опала состава SiO 2 ∙ п H 2 O; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получается из метасиликата натрия:
Силикагель имеет развитую поверхность, а поэтому хорошо адсорбирует влагу.
При 1710° кварц плавится. При быстром охлаждении расплавленной массыобразуется кварцевое стекло. Оно имеет очень малый коэффициент расширения, благодаря чему раскаленное кварцевое стекло не трескается при быстром охлаждении водой. Из кварцевого стекла изготовляют лабораторную посуду и приборы для научных исследований.
Структуру SiO 2 в плоскостном изображении можно представить так:
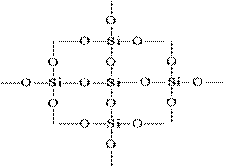
Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При этом атом кремния находится в центре, а по вершинам тетраэдра расположены атомы кислорода. Весь кусок кремнезема можно рассматривать как кристалл, формула которого (SiO 2)n. Такое строение оксида кремния (IV) обусловливает его высокую твердость и тугоплавкость.
По химическим свойствам оксид кремния (IV) SiO 2 относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты:
С оксидом кремния (IV) взаимодействует только плавиковая кислота (травление стекла):
SiO 2 + HF → SiF 4 + H 2 O
В воде оксид кремния (IV) не растворяется и с ней химически не взаимодействует. Поэтому кремниевую кислоту получают косвенным путем, например, гидролизом:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 ортокремниевая кислота.
H 4 SiO 4 растворима, при нагревании или стоянии идёт процесс полимеризации:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 диортокремниевая кислота.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 тетраортокремниевая кислота.
Она замыкается в кольцо:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 тетраметакремниевая кислота.
При этом кремниевая кислота(в зависимости от концентрации исходных растворов соли и кислоты) может быть получена как в виде студнеобразной массы, содержащей воду, так и в виде коллоидного раствора (золя). Состав полученных кремниевых кислот зависит от исходных веществ и условий получения. Все кремниевые кислоты очень слабые (слабее угольной).
Если в растворе угольная кислота выделяет кремневую из её солей, то при прокаливании идёт обратная реакция. Первая обусловлена меньшей силой (степенью диссоциации) кремневой кислоты, вторая - её меньшей летучестью при нагревании.
При нагревании поликремниевых кислот и постепенном их обезвоживании можно получить тонкодисперсный SiO 2 , который называют силикагелем . Он хорошо поглощает воду, его помещаю в приборы для предотвращения окисления дорогих элементов.
Подгруппа германия
Ge (+4) Sn (+2, +4) Pb (+2) - устойчивые степени окисления
Германий был предсказан Д. И. Менделеевым в 1871 г., а открыт в 1886 г. Олово и свинец принадлежат к наиболее давно известным человечеству элементам: египтяне умели выплавлять их из руд более чем за 3000 лет до н. э. В Индии свинец стал известен около 2500 лет, а олово 1500 лет до н. э. Выплавка олова производилась и в древнем Китае.
Получение. Природные соединения германия переводят в GeO 2 и восстанавливают водородом:
GeO 2 + H 2 t → Ge + H 2 O при температурах около 1000 °С.
Олово получают из природного минерала касситерита (SnO 2):
SnO 2 + С → Sn + CO.
Простейшая схема промышленного восстановления свинца основывается на двух последовательных реакциях:
PbS + O 2 → SO 2 + PbO Галенит (PbS) обжигают, а затем восстанавливают углём:
PbO + С → СO + Pb.
Применение. Все три элемента весьма важны для современной техники. Значительное применение находят также некоторые соединения олова и свинца. Производные свинца сильно ядовиты.
Германий является типичным полупроводником (n-типа с шириной запрещённой зоны 0,75 эВ) и находит разнообразное использование в электротехнике. Наиболее широко он применяется для изготовления выпрямителей переменного тока . Применение это основано на униполярной проводимости, возникающей при контакте между чистым германием и сплавом германия с индием. Ток (поток электронов) проходит в такой установке практически только от германия к сплаву, но не наоборот. Германиевые выпрямители характеризуются чрезвычайно высоким (порядка 98%) коэффициентом полезного действия и очень большим (при правильной эксплуатации) сроком службы. Основным недостатком таких выпрямителей является их чувствительность к нагреванию - выше 70 °С их эффективность быстро падает.
Важной областью использования германия является инфракрасная оптика, так как лучи с длиной волны больше 2 мк он практически не задерживает. Напротив, в световом и близких к нему диапазонах (0,2 ? 2 мк) германий интенсивно поглощает энергию. Если блестящую металлическую поверхность (которая хорошо хранит тепло, но плохо нагревается) покрыть пленкой германия, то поверхность нагревается гораздо сильнее, чем без плёнки. Сообщалось, что в подготовленной таким образом бочке под действием солнечного света можно получить кипяток.
Олово используется главным образом для лужения железа с целью предохранения его от ржавления (белая жесть для консервной промышленности). Толщина таких оловянных покрытий очень мала - порядка микронов. В виде тонких листков (т. н. станниоля) олово потребляется для изготовления конденсаторов в электротехнической промышленности. Свинец применяется для изготовления аккумуляторных пластин, обкладок электрических кабелей, пуль и дроби, для защиты от рентгеновского излучения и g-лучей, а также в химической промышленности (трубопроводы и т. д.). Очень большие количества олова и свинца расходуются на изготовление ряда технически важных сплавов.
Важнейшими из них являются различные бронзы (сплавы Cu и Sn), сплавы для подшипников (баббиты, изготовляемые обычно на основе Pb или Sn и содержащие так же Sb и Cu), типографские сплавы (5-30% Sn, 10-20% Sb, остальное Pb) и обычный “мягкий” припой (30-70% Sn, 70-30% Pb). Его заменителем часто может служить более дешевый сплав состава 90% Pb, 6% Sn, 4% Sb. Большое значение имеют сплавы для подшипников приблизительного состава 98% Pb, 1% Ca, 1% Na.


